La cirugía de glaucoma ha tenido un gran desarrollo en las últimas dos décadas. Una de las vías sobre la que se ha experimentado es la vía supracoroidea. El auge y posterior caída de una de las técnicas quirúrgicas que más prometía, el implante supracoroideo CyPass, ha puesto en boga nuevamente el empleo de esta vía en el tratamiento del glaucoma. En esta entrada, se intentan resumir los mecanismos por los que tendría sentido, al menos desde un punto de vista teórico, emplear esta vía, y las alternativas quirúrgicas que existen sobre ella.
El drenaje supracoroideo
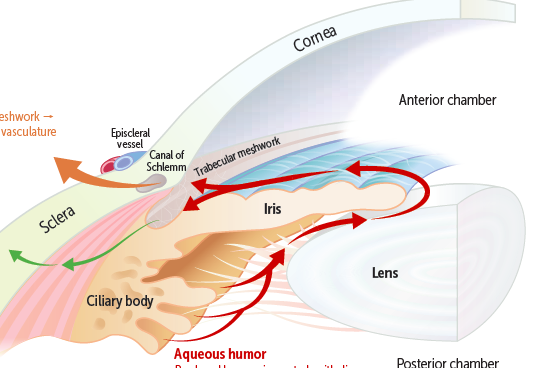
El humor acuoso, para completar su ciclo, abandona el segmento anterior de dos vías: la vía convencional, o vía trabecular, y la vía supracoroidea. La vía trabecular es la que aporta la mayor cantidad de drenaje, estimado entre un 80-90% del total1. Sin embargo, en 1965, Anders Bill descubrió que existía una vía de drenaje de humor acuoso, que se estima en un 20% del total. Por tanto, se trata de una vía en la que, en ausencia de un mecanismo añadido a este nivel que impidiera el drenaje, es una vía sobre la que se podría lograr un drenaje “extra” del humor acuoso.
El humor acuoso seguiría en esta vía la ruta: cámara anterior → raíz del cuerpo ciliar → fibras del músculo ciliar → espacio supracoroideo àdrenaje a través del plexo intraescleral, poros esclerales, y la porción uveal posterior (coroides).
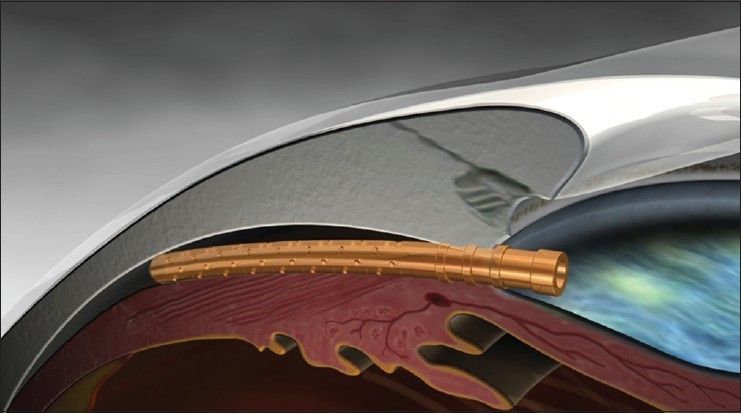
Fuente: masscience.com
Terapéutica de la vía supracoroidea
Sabiendo de la existencia de esta vía, parece lógico buscar aumentar el drenaje del humor acuoso por este mecanismo.
- Análogos de prostaglandinas (PGA)
Los análogos de prostaglandinas son el grupo farmacológico principal que actúa sobre la vía no convencional. Producen un aumento mínimo de la producción del humor acuoso, que sin embargo no parece repercutir en el efecto hipotensor de aumento del flujo de salida del acuoso. Se han propuesto dos mecanismos sobre los que actúan estos fármacos:- Relajación del músculo ciliar. Se observó que, mientras la pilocarpina, al aumentar el tono del músculo ciliar bloqueaba el flujo uveoescleral, los PGA producían relajación del músculo ciliar y mayor salida de humor acuoso por esta vía2.
- Modificación de la matriz extracelular3. La renovación a este nivel se produce por el equilibrio entre las metaloproteasas de matriz (MMP), que degradan entre otros varios tipos de colágenos, y la inhibición de las MMP (TIMP). Se ha visto que algunos PGA como el latanoprost inducen un aumento de las MMP a nivel del músculo liso, generando más “espacios” por donde fluye el humor acuoso. Este efecto también se ha observado parcialmente sobre la malla trabecular.
- Bypass de la vía supracoroidea
Los estudios en animales probaron que la esclera ejerce poca resistencia a la salida del humor acuoso, y que los vasos coroideos absorben el humor acuoso que les llega. Por esto, se postuló que la mayor resistencia se encuentra a nivel del músculo ciliar.A nivel del músculo ciliar encontramos tejido conectivo. El tejido conectivo supone un total del área en torno al 20%, que se ha visto que aumenta con la edad hasta llegar a un 50% en los pacientes de 60 o más años2. Tiene sentido entonces que, si existiera una comunicación directa con el espacio coroideo, se lograría un “bypass” de dicha resistencia. - Desprendimiento del cuerpo ciliarLa salida de humor acuoso en la vía convencional es presión dependiente: si aumenta la PIO, también aumenta el drenaje de humor acuoso a nivel trabecular. Este comportamiento es casi exponencial, como demostraron representaron Nilsson y Bill en 1994. La vía uveoescleral sin embargo, se ha considerado presión independiente, por lo que los aumentos en la producción de humor acuoso apenas tienen repercusión sobre el flujo de salida.Sin embargo, esto no se cumple en dos situaciones: por una parte, presiones por debajo de 4 mmHg hacen que la vía uveoescleral tenga un flujo cercano a cero. Por otra, se descubrió que sí existe un gradiente y efecto presión-dependiente, cuando se produce un desprendimiento del cuerpo ciliar. Que la ciclodiálisis tiene un efecto hipotensor, como ocurre tras un traumatismo, era ya un efecto conocido. La creación de una ciclodiálisis controlada generaría una alternativa quirúrgica para favorecer el drenaje de humor acuoso, como ya se investigó con materiales previos, como el teflón o la silicona.
Cirugía sobre la vía supracoroidea
El uso de la vía supracoroidea se ha explorado en la cirugía, surgido por el interés de algunas de las ventajas teóricas y no teóricas sobre esta vía:
- El efecto hipotensor generado por una ciclodiálisis controlada
- La “eliminación” de la resistencia del músculo ciliar
- El empleo de una cirugía que no precisa de ampolla de filtración
- Logro teórico de una PIO inferior a la presión venosa epiescleral
La vía supracoroidea, de hecho, ha sido también uno de los objetivos en las cirugías “clásicas”. El empleo de implantes como el Esnoper V2000 o directamente una lámina de Ologen®, buscan añadir otra ruta de drenaje del humor acuoso a la esclerectomía profunda no perforante(4,5).
En el caso de las técnicas MIGS, al ser teóricamente de eficacia moderada, estas cirugías buscan, en la medida de lo posible, la preservación de la conjuntiva para las cirugías filtrantes o los dispositivos de drenaje. Esto se consigue parcialmente en tanto que, aunque no generan ampolla de filtración, en algunas cirugías se necesita hacer una disección conjuntival para implantar el dispositivo.
Por eso, al igual que en otras MIGS, también se clasifican en:
- Ab interno: cirugías a través de una incisión en córnea clara, comunican el humor acuoso con el espacio trabecular, subconjuntival o supracoroideo.
- Ab externo: cirugías realizadas a través de una disección conjuntival, más o menjos amplia, que comunica el humor acuoso con el espacio trabecular, subconjuntival o supracoroideo, no necesariamente con creación de un tapete escleral.
Las técnicas quirúrgicas que encontramos hoy en día están asociadas al implante de un dispositivo, de un material biocompatible, que permita lograr el efecto hipotensor por los mecanismos descritos hasta ahora, y que dicho material no genere una respuesta fibroblástica que genere cicatrización y que lleve al fracaso de la cirugía.
I. Gold Micro Shunt
¿Qué es?
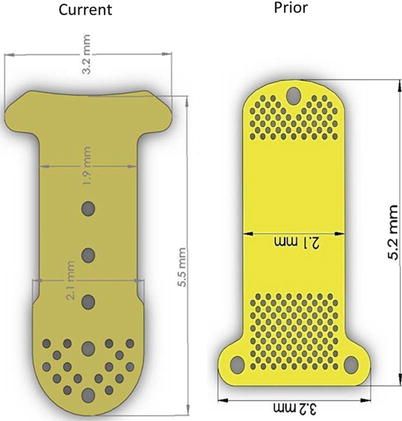
El Gold Micro Shunt® (Gabriel Simón Valve®, o GMS) es un implante de oro de 24 quilates, un material bien tolerado a nivel intraocular(6). Está formado por dos láminas de 5,5 mm de longitud, con forma de T. Las láminas están separadas entre sí por una serie de postes, y para que fluya el humor acuoso a su través, consta de 9 aperturas con un lumen de 70, 80 y 120 µm en la parte anterior (los tres modelos probados), a modo de malla trabecular. Tienen un ancho y una separación entre sí de 100 µm. El humor acuoso se dirige hacia la parte posterior, y drena a través de las perforaciones que tiene tanto en las láminas, 16 sobre la parte posterior, y 16 también en el reborde posterior.
¿Cómo se implanta?
Es un dispositivo ab externo. Habitualmente se implanta subpalpebral, aunque se podría situar a cualquier nivel en la circunferencia limbar. Este vídeo, del propio Dr. Gabriel Simón, muestra la técnica quirúrgica.
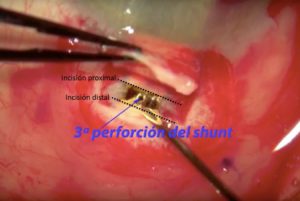
Tras la disección conjuntival, se diseca un colgajo escleral con base limbar, de 3,5 x 3,5 mm y de un 90% de profundidad, dejando expuesto el espolón escleral. En el lecho se crean dos marcas más, de 3 mm, paralelas al limbo, una a 0,5 mm (proximal) y otra a 1,5 mm (distal). A continuación, se produce la disección entre esclera y coroides, con ayuda de viscoelástico (para evitar el daño directo) y un cuchillete. La disección se hará en dos sentidos: desde la incisión proximal hacia cámara anterior, perforando y entrando – previa descompresión para evitar la reducción brusca, y desde la incisión distal hacia el polo posterior del globo. Después de la disección posterior, se puede optar por implantar un fragmento de Ologen® entre esclera y coroides.
Una vez creado el lecho, se coloca el implante mediante el transportador, situando la cabeza o parte en forma de T en cámara anterior. El implante quedaría completamente en contacto con la coroides, excepto en la porción correspondiente a la 3ª perforación del shunt, que quedaría sobre esclera (la banda no disecada entre la incisión proximal y distal en el lecho).
Por último, una vez comprobada la posición correcta, se cierra el colgajo escleral y la conjuntiva de manera hermética para evitar la formación de ampolla de filtración.
Resultados
Aún están por publicar los resultados con el nuevo modelo, pero existen ya datos de la eficacia del implante.
En una serie prospectiva a un año de Melamed y Simón(7), en 38 pacientes, obtuvieron una reducción de 9 mmHg y un éxito quirúrgico del 79%, aunque con reducción de 0,5 colirios al final del seguimiento. Durante ese periodo de seguimiento, solo obtuvieron una complicación grave, un desprendimiento de retina seroso, aunque no se especificó la etiología.
En el único ensayo clínico controlado y aleatorizado publicado hasta la fecha, Skaat y colaboradores observaron que la eficacia hipotensora en términos de disminución de PIO y de reducción de número de colirios, era similar entre los pacientes que se le implantaba una válvula de Ahmed, frente a dos modelos distintos de la versión anterior del GMS (24 y 48 µm). Además, el porcentaje de complicaciones típicas de las cirugías de glaucoma (desprendimiento coroideo, hipotonía, cámara anterior plana) era similar entre los tres dispositivos(8).
Los resultados del propio autor, comparando los modelos GS70, 80 y 120, muestran también un descenso y perfil de seguridad moderados a largo plazo(9).
En un estudio de cuidadoso diseño realizado por Mastropasqua et al(10), se observó que el mecanismo de drenaje podría radicar no solo en el drenaje supracoroideo – como sugiere el espacio hiporreflectivo entre el dispositivo y esclera, sino que favorecería el drenaje transenscleral sin presencia de ampolla, al aumentar el número de células caliciformes con contenido acuoso.
Funciona, pero…
Ocurre no solo con este, sino con otras cirugías MIGS, que el éxito inicial que mostraba, no tiene tanta magnitud cuando pasa el tiempo.
En el caso del GMS, se observó que con el tiempo se aumentaba nuevamente el número de fármacos hipotensores. Además, en los implantes retirados (aumento del grosor corneal) se observó la presencia de fibroblastos tanto alrededor como dentro de los canales, además de un material amorfo y presencia de células gigantes, lo que sugiere niveles crónicos (aunque bajos) de inflamación, también a nivel del espacio supracoroideo(11).
En un estudio retrospectivo en el que se analizaron 31 implantes, a los dos años se encontró un 97% de fracasos (no cumplimiento de PIO > 5 mmHg y < 21 mmHg y descenso > 20%, o reintervención distinta de la recolocación del implante). Aunque los autores reconocen que la técnica de implante no es exactamente la descrita por el autor, les llama la atención el porcentaje de fracaso y la aparición de rubeosis iridiana no explicada por otra comorbilidad(12).
II. Aquashunt
¿Qué es?
El Aquashunt® (OPKO Health, Inc.) es un dispositivo creado por el Dr. B Shields en la Universidad de Yale. Se ideó como un implante quirúrgico que debía cumplir varios criterios como facilidad y curva de aprendizaje corta, barato y con poco manejo postoperatorio, para facilitar su empleo en áreas de menos recursos.

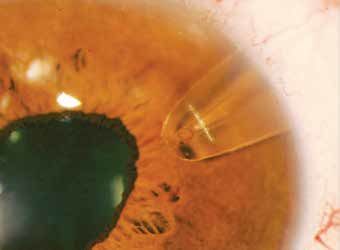
El implante está realizado completamente en polipropileno, y tiene unas dimensiones de 10 mm de longitud, 4 mm de envergadura y 0,75 de grosor. Está ligeramente curvado, y en su porción anterior, tiene una punta con un agujero de 250 µm por el que el humor acuoso desde la cámara anterior pasaría al cuerpo, y posteriormente al espacio supracoroideo. Posee cuatro perforaciones que permiten suturarlo a esclera.
¿Cómo se implanta?
Se trata de otro implante ab externo. Se accede a través de esclera, creando un plano de disección entre esclera y coroides con una espátula diseñada a tal fin, hasta acceder a cámara anterior. La porción distal del dispositivo va “enterrada” en esclera, por detrás de la zona de incisión, y se ancla a esclera mediante gracias a las cuatro perforaciones del implante. Posteriormente se cierra de manera hermética esclera y conjuntiva para evitar la formación de ampolla de filtración.
Resultados
En 2009, se publicó el ensayo clínico aprobado que tuvo lugar en República Dominicana (https://clinicaltrials.gov/ct2/show/NCT00834223). Sin embargo, según la Academia Americana, los resultados no llegaron a publicarse. Hay, sin embargo, estudios que intentan determinar su eficacia y seguridad. En un estudio comparativo en modelo animal (conejo blanco de Nueva Zelanda) entre el GMS y el AquaShunt, se observó que el descenso de PIO era mayor en el Aquashunt. La reacción histológica era mayor en la porción escleral que en la supracoroidea, por lo que su uso tendría sentido y no comprometería a priori la funcionalidad de la cirugía(13).
Sin embargo, parece que el AquaShunt podría tener más complicaciones, en tanto que presentaba complicaciones graves como desprendimiento de retina o deslizamiento del implante hacia cámara anterior. No obstante, esto debe ser aún corroborado, en tanto que en el experimento, se optó por implantar ambos dispositivos vía ab interno(13).
Funciona, pero…
Aún no se puede determinar el perfil de seguridad en humanos.
III. STARFlo
¿Qué es?
El implante STARflo (iSTAR Medical, Isnes, Belgium) es un dispositivo flexible de implantación ab externo. Está realizado en material STAR, un biomaterial derivado de un elastómero de silicona. Se han diseñado dos versiones, la segunda comercializada (V2) es una lámina microporosa de 8 mm de longitud por 5 mm ancho, y un grosor de 275 µm. La morfología puede recordar al GMS, con una parte anterior en forma de yunque que entra en cámara anterior, un cuello de 3 mm y una parte posterior que se implanta tanto intraescleral como supracoroideo(14,15).
¿Cómo se implanta?
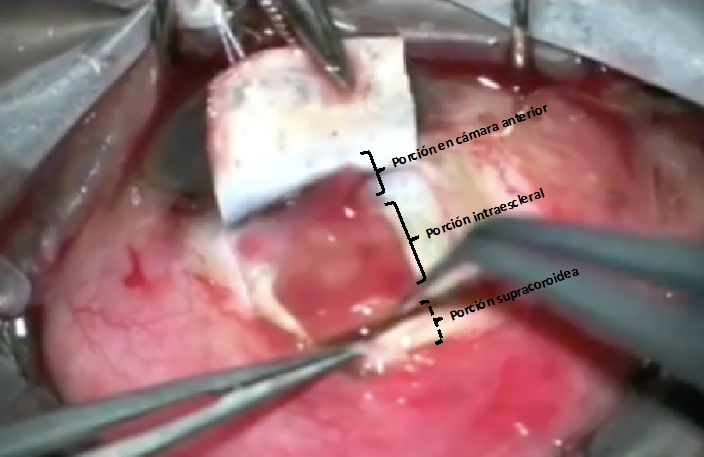
La técnica quirúrgica recuerda a la del GMS. En este caso, tras la peritomía, se realiza un tapete escleral de 3 mm x 7 mm de ancho y del 50% del espesor escleral. Sobre ese lecho escleral, en el borde posterior se realiza una incisión de 5-6 mm con disección también hacia la coroides, y posterior disección con viscoelástico. Además, se realiza una incisión de 3 mm para acceder a cámara anterior. De esta manera, encontraríamos el dispositivo en cámara anterior, intraescleral y supracoroideo. La cirugía finaliza con el cierre del tapete escleral y la conjuntiva.
Resultados
Existen datos del implante desde el año 2013, aunque en este caso, la cirugía también generaba una ampolla de filtración(16). En 2016, István y colaboradores publicaron una serie de 7 casos de glaucomas de varias etiologías, incluidos dos casos de glauoma neovascular. Empleando los dos modelos, V1 y V2, lograron una reducción del 32% de PIO y una reducción de colirios de 4,5 a 2,3 a los seis meses(17). En la serie de 29 pacientes publicada por Fili y colaboradores(18), 29 pacientes adultos con glaucoma de ángulo abierto, pseudoexfoliativo y congénito, con cirugías previas fracasadas, fueron sometidos al implante del STARflo. A los 12 meses, se había logrado una reducción del 28,8% de PIO y un descenso de 2,7 a 0,9 colirios, sí significativo. Sin embargo, probablemente por ser pacientes con glaucomas refractarios, en 11 pacientes fue necesario el manejo de picos hipertensivos que duraron hasta seis meses. En 3 de ellos se logró con acetazolamida oral, mientras que en los otros ocho fueron necesarios maniobras quirúrgicas (transciclofotocoagulación, trabeculectomía e implante de válvula de Ahmed).
Funciona, pero…
La falta de series largas y de seguimiento superior a 12 meses limitan el hecho de valorar su seguridad. En la serie publicada en 2003, Pourjavan y colaboradores encontraron casos de hipotonía, hemorragia coroidea y maculopatía, en tres de cuatro pacientes operados, aunque estos duraron menos de 3 meses(16).
** Existe una nueva versión, el STARflo MINIject, diseñada para ser implantada vía ab interno. Aún no existen resultados con esta nueva versión.
https://www.istarmed.com/products/miniject-migs/

IV. iStent Supra
¿Qué es?
El iStent Supra o modelo G3 (Glaukos® Corporation, Laguna Hill, California, EE.UU.) es la tercera generación de implantes angulares de Glaukos. En este caso, se trata de un micro-stent para favorecer la vía supracoroidea. Es un dispositivo cilíndrico, ligeramente curvado, formado por polietersulfona y titanio. Tiene una longitud de 4 mm y un lumen de 165 µm.

¿Cómo se implanta?
En este vídeo del Dr. Belda podemos ver la técnica quirúrgica
Al igual que en otras cirugías angulares, es fundamental la visualización correcta del ángulo. Tras estabilizar la cámara anterior con viscoelástico, se gira el cabezal del microscopio hacia el cirujano y la cabeza del paciente hacia el otro. Tras comprobar que se visualiza bien el ángulo, se procede a introducir el iStent Supra con el aplicador de un solo uso, entre el espolón escleral y la raíz del cuerpo ciliar. Quedarán en cámara anterior 0,4-0,7 mm del implante. Se lava el viscoelástico y se sellan las incisiones, que pueden ser de 1,5 o de 2,2 mm en función de si se combina o no con cirugía de cataratas.
Resultados
Los trabajos publicados hasta la fecha no han medido la magnitud del efecto hipotensor por si solo del implante. En una comunicación de Jünemann en el congreso de la ESCRS, observó un descenso del 20% y reducción en 1 fármaco en un 98% de los pacientes, aunque tratados postoperatoriamente con travoprost(19).
En otro estudio similar, en pacientes con una cirugía filtrante previa, se evaluó la combinación de 2x iStent, 1 iStent Spra y travoprost. Los resultados mostraron que por sí mismos, la combinación de dos implantes trabeculares y uno supracoroideo generaba un descenso superior al 30%, cuando se realizaba, una vez al año, un mes de periodo de lavado del análogo de prostaglandina. Además, presentó un perfil de seguridad alto, en el que no se observaron complicaciones que amenazaran a la visión, salvo el desarrollo de cataratas, y sin afectación del grosor corneal, en cuatro años de seguimiento(20).
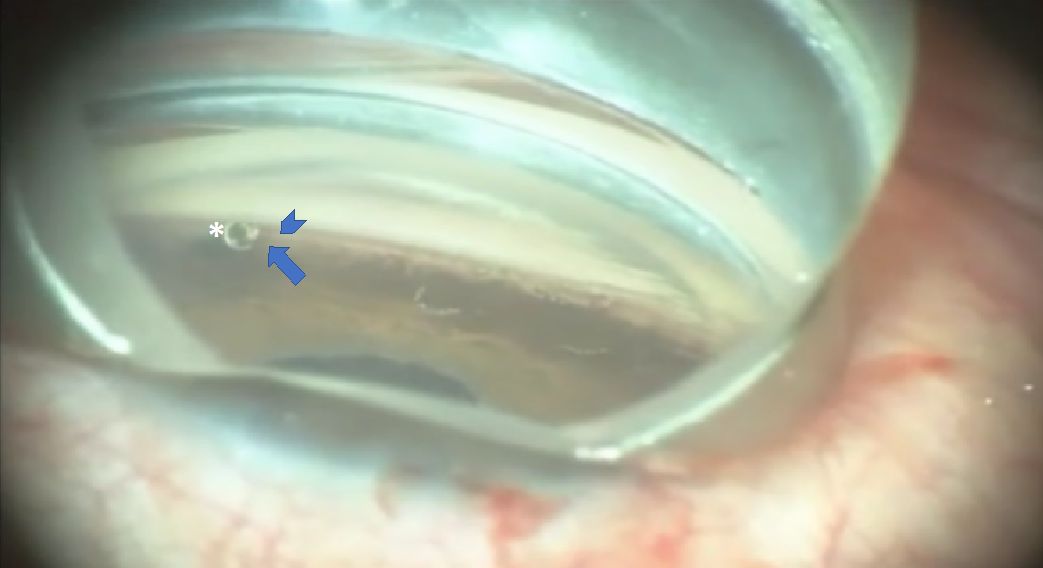
Funciona, pero…
A falta de estudios a largo plazo, parece un implante seguro y que hasta ahora no ha mostrado complicaciones, salvo las que puedan surgir por complicaciones técnicas a la hora de implantarlo.
V. CyPass
¿Qué es?
El MicroStent Cypass (Alcon Laboratories, Fort Worth, Texas, EE.UU.) es, probablemente, el dispositivo supracoroideo más empleado y conocido. Se trata de un stent de 6,35 mm de longitud, 510 µm de diámetro y 300 µm de diámetro interno, y múltiples microperforaciones en su longitud a través de las cuales sale el humor acuoso. Está fabricado en su totalidad de una poliamida biocompatible, y tiene una forma curva para adaptarse al ojo, como otros dispositivos. Para lograr que no se desplace, en su parte anterior tiene otros tres anillos de retención, además del de la apertura en cámara anterior. El dispositivo obtuvo la marca CE en Europa en 2008, y en julio 2016 la aprobación por parte de la FDA.
El dispositivo tiene la particularidad de que fue el primer stent comercializado que potencia la vía supracoroidea, vía ab interno, pudiendo implantarse a través de una microincisión vía córnea clara del mismo tamaño (y localización) que las empleadas para cirugía de cataratas.
En un estudio in vivo de Saheb y colaboradores, observaron con OCT de segmento anterior que el implante del CyPass producía la aparición de zonas hiporreflectivas (humor acuoso) por la ciclodiálisis, pero también en laregión posterior y entre el implante y la esclera. Con el tiempo, la ciclodiálisis es menor y se produce un remodelado de estas zonas, persistiendo sobre todo el acúmulo entre esclera y en la región posterior(21).
¿Cómo se implanta?
Nuevamente, es muy importante la visualización correcta del ángulo. Tras estabilizar la cámara anterior con viscoelástico, se gira el cabezal del microscopio hacia el cirujano y la cabeza del paciente hacia el otro hasta aproximadamente 45º. Habitualmente, se coloca (por ergonomía) en el sector nasal o inferior. Después de cargar el CyPass en el aplicador, a través de una incisión de 1,8 o 2,2 mm, se introduce el CyPass en la banda entre la raíz del cuerpo ciliar y el espolón escleral, sin arrastrar el iris. En este momento, es importante comprobar que el CyPass queda bien colocado, mostrando 1-2 anillos en cámara anterior. En ese momento, se pulsa el botón que libera el dispositivo del aplicador, y con el aplicador o una espátula, se modifica si la posición final no es la correcta. Por último, se lava el viscoelástico.
Dos ejemplos:
1) Implante CyPass:
2) Facoemulsificación + Implante CyPass

Resultados
Este dispositivo mostró resultados prometedores, publicados en 3 grandes estudios: CyCLE, DUETTE y COMPASS.
- Estudio CyCLE. Este estudio por Hoëh y colaboradores(22), obtuvo resultado de 82 pacientes a 24 meses, en los que se combinaba cirugía de cataratas e implante CyPass. Los autores clasificaron a los pacientes en función de la PIO basal (< o > 21 mmHg), y observaron que el mayor descenso se obtenía en aquellos pacientes con PIO preoperatoria > 21 mmHg, y que en ambos grupos se lograba una reducción significativa del número de colirios, de 2,1 fármacos a 1 fármaco a los 24 meses en ambos grupos.
- Estudio DUETTE. El estudio DUETTE, por García-Feijoo y colaboradores(23), publicó resultados a 1 y 2 años. En los sujetos de estudio, se realizó únicamente cirugía de implante de CyPass, independientemente del estado del cristalino. En los resultados a un año, se observó que la PIO se reducía en un 34,7%, y que la reducción del número de colirios era de 2,2 a 1,4. Estas proporciones, así como el nº de pacientes que cumplían criterios de éxito absoluto y relativo se mantuvieron también a los 24 meses(24), consiguiendo hasta un 29,2% a los dos años que no precisaron de reintroducción de medicación tópica.
- Estudio COMPASS. Este estudio, por Vold et al.(25), publicó en 2016 resultados favorables que influyeron en la aprobación del CyPass por parte de la FDA. Este estudio, un ensayo clínico aleatorizado de 505 pacientes, con resultados años, comparó resultados de la realización de solo facoemulsificación frente a la combinación con CyPass. Tras dos años, la reducción de PIO fue de 7,4 mmHg en cirugía combinada frente a los 5,4 mmHg obtenidos con la cirugía de cataratas. Aunque este descenso de 7 mmHg era similar a la implantación del CyPass como procedimiento único, el COMPASS logró sin embargo hasta un 85% de pacientes sin medicación cuando se combinaban ambas cirugías, y una reducción de fármacos a los dos años de 0,2 principios activos.
Funciona, pero…
El hecho de ser uno de los implantes más estudiados también ha llevado a que se haya descrito mejor su perfil de seguridad. En los tres grandes ensayos, se observaron pacientes con picos hipertensivos, hipotonías transitorias, progresión de la catarata o hipema transitorio en la mayor parte de los casos. En algunos casos, el lumen del stent quedaba parcialmente obstruido por sinequias anteriores, lo cual se podía resolver con láser YAG(23).
Este perfil de seguridad, sin embargo, se cuestionó con los resultados del COMPASS XT, el ensayo clínico que evaluaba los resultados a 5 años. En agosto de 2018, Alcon decidió retirar el CyPass. En la reunión de Viena de 2018 de la ESCRS, se presentaron los resultados de seguridad y eficacia del COMPASS XT. En los pacientes con cirugía combinada, se observó una pérdida endotelial del 20,4% frente al 10,1% operados de cataratas. Además, el % de pacientes que perdían > de un 30% de células endoteliales respecto al basal era del 27,2% frente al 10%. Se observó una correlación con el número de anillos visibles en la gonioscopia, encontrando un mayor porcentaje de pérdida endotelial (10 veces superior al 0,6% fisiológico) cuando eran visibles entre 2 y 3 anillos.
Sin embargo, solo un paciente presentó edema corneal que resolvió antes de la finalización del seguimiento de 60 meses. Acorde con esto, el análisis de expertos llevado a cabo por la ASCRS concluyó que, a partir de 2 anillos visibles, la acción más recomendable era un seguimiento más exhaustivo, y que en el caso de que se desarrollara descompensación corneal, más allá de los 7-10 días tras la implantación, no era recomendable el reposicionamiento y sí, en el caso de realizar una acción, recortar el extremo proximal.
Además, fuera de los hallazgos reportados por el COMPASS-XT, tal y como señaló el Dr. Badoza, algunos cirujanos experimentaron atalamias postquirúrgicas, con miopización secundaria al adelantamiento de la LIO.
http://ascrs.org/CyPass_Statement
https://www.alcon.com/content/cypass-micro-stent-market-withdrawal
VI. Implante Supraject
Aún está en experimentación animal. Este dispositivo, de aspecto similar al STARflo MINIject, está fabricado en fluoruro de polivinilideno, empleado en la técnica WesternBlot. La anatomía patológica de los ojos de conejo en los que se implantó mostró ausencia de cápsula fibrosa. Aún no se ha probado en humanos.
http://ies.ijo.cn/gjykcn/ch/reader/view_abstract.aspx?file_no=201710002&flag=1
La vía supracoroidea parece, a día de hoy, que aún tiene vigencia. Aunque queda por encontrar los dispositivos que “menos daño hagan” (primum non nocere), el futuro de la cirugía de glaucoma sobre esta vía parece prometedor.
Bibliografía
- Tamm ER, Braunger BM, Fuchshofer R. Intraocular Pressure and the Mechanisms Involved in Resistance of the Aqueous Humor Flow in the Trabecular Meshwork Outflow Pathways. Prog Mol Biol Transl Sci. 2015;134:301-314. doi:10.1016/bs.pmbts.2015.06.007.
- Alm A, Nilsson SFE. Uveoscleral outflow–a review. Exp Eye Res. 2009;88(4):760-768. doi:10.1016/j.exer.2008.12.012.
- Winkler NS, Fautsch MP. Effects of prostaglandin analogues on aqueous humor outflow pathways. J Ocul Pharmacol Ther. 2014;30(2-3):102-109. doi:10.1089/jop.2013.0179.
- Belda JI, Loscos-Arenas J, Mermoud A, et al. Supraciliary versus intrascleral implantation with hema implant (Esnoper V-2000) in deep sclerectomy: a multicenter randomized controlled trial. Acta Ophthalmol. May 2018:1-7. doi:10.1111/aos.13749.
- Szurman P, Januschowski K, Boden KT, Seuthe A-M. Suprachoroidal drainage with collagen sheet implant- a novel technique for non-penetrating glaucoma surgery. Graefes Arch Clin Exp Ophthalmol. 2018;256(2):381-385. doi:10.1007/s00417-017-3873-9.
- Sen SC, Ghosh A. Gold as an intraocular foreign body. Br J Ophthalmol. 1983;67(6):398-399. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1040073&tool=pmcentrez&rendertype=abstract.
- Melamed S, Ben Simon GJ, Goldenfeld M, Simon G. Efficacy and safety of gold micro shunt implantation to the supraciliary space in patients with glaucoma: a pilot study. Arch Ophthalmol (Chicago, Ill 1960). 2009;127(3):264-269. doi:10.1001/archophthalmol.2008.611.
- Skaat A, Sagiv O, Kinori M, Ben Simon GJ, Goldenfeld M, Melamed S. Gold Micro-Shunt Implants Versus Ahmed Glaucoma Valve: Long-term Outcomes of a Prospective Randomized Clinical Trial. J Glaucoma. 2016;25(2):155-161. doi:10.1097/IJG.0000000000000175.
- Lavín-Dapena C, Alcocer-Yuste P. Cirugía Microincisional Del Glaucoma. 1a. (Oftalmología SE de, ed.). Industria Gráfica MAE; 2016.
- Mastropasqua L, Agnifili L, Ciancaglini M, et al. In vivo analysis of conjunctiva in gold micro shunt implantation for glaucoma. Br J Ophthalmol. 2010;94(12):1592-1596. doi:10.1136/bjo.2010.179994.
- Rękas M, Pawlik B, Grala B, Kozłowski W. Clinical and morphological evaluation of gold micro shunt after unsuccessful surgical treatment of patients with primary open-angle glaucoma. Eye (Lond). 2013;27(10):1214-1217. doi:10.1038/eye.2013.154.
- Hueber A, Roters S, Jordan JF, Konen W. Retrospective analysis of the success and safety of Gold Micro Shunt Implantation in glaucoma. BMC Ophthalmol. 2013;13(1):35. doi:10.1186/1471-2415-13-35.
- Oatts JT, Zhang Z, Tseng H, Shields MB, Sinard JH, Loewen NA. In vitro and in vivo comparison of two suprachoroidal shunts. Invest Ophthalmol Vis Sci. 2013;54(8):5416-5423. doi:10.1167/iovs.13-11853.
- Vinod K. Suprachoroidal shunts. Curr Opin Ophthalmol. 2018;29(2):155-161. doi:10.1097/ICU.0000000000000458.
- Gigon A, Shaarawy T. The Suprachoroidal Route in Glaucoma Surgery. J Curr glaucoma Pract. 2016;10(1):13-20. doi:10.5005/jp-journals-10008-1197.
- Figus M, Posarelli C, Passani A, et al. The supraciliary space as a suitable pathway for glaucoma surgery: Ho-hum or home run? Surv Ophthalmol. 2017;62(6):828-837. doi:10.1016/j.survophthal.2017.05.002.
- Cseke I, Vámosi P, Bausz M. Starflo glaucoma implant: early experience in Hungary. Rom J Ophthalmol. 2016;60(1):14-17. http://www.ncbi.nlm.nih.gov/pubmed/27220226.
- Fili S, Wölfelschneider P, Kohlhaas M. The STARflo glaucoma implant: preliminary 12 months results. Graefes Arch Clin Exp Ophthalmol. 2018;256(4):773-781. doi:10.1007/s00417-018-3916-x.
- Jünemann A. Twelve-month Outcomes Following Ab Interno Implantaton of Suprachoroidal Stent and Postoperative Administration of Travoprost to Treat Open Angle Glaucoma. 31st Congr Eur Soc Cataract Refract Surg. 2013. http://escrs.org/amsterdam2013/programme/posters-details.asp?id=19512.
- Myers JS, Masood I, Hornbeak DM, et al. Prospective Evaluation of Two iStent®Trabecular Stents, One iStent Supra®Suprachoroidal Stent, and Postoperative Prostaglandin in Refractory Glaucoma: 4-year Outcomes. Adv Ther. 2018;35(3):395-407. doi:10.1007/s12325-018-0666-4.
- Saheb H, Ianchulev T, Ahmed IIK. Optical coherence tomography of the suprachoroid after CyPass Micro-Stent implantation for the treatment of open-angle glaucoma. Br J Ophthalmol. 2014;98(1):19-23. doi:10.1136/bjophthalmol-2012-302951.
- Höh H, Grisanti S, Grisanti S, Rau M, Ianchulev S. Two-year clinical experience with the CyPass micro-stent: safety and surgical outcomes of a novel supraciliary micro-stent. Klin Monbl Augenheilkd. 2014;231(4):377-381. doi:10.1055/s-0034-1368214.
- García-Feijoo J, Rau M, Grisanti S, et al. Supraciliary micro-stent implantation for open-angle glaucoma failing topical therapy: 1-year results of a multicenter study. Am J Ophthalmol. 2015;159(6):1075-1081.e1. doi:10.1016/j.ajo.2015.02.018.
- Garcìa-Feijoo J, Höh H, Uzunov R, Dickerson JE. Supraciliary Microstent in Refractory Open-Angle Glaucoma: Two-Year Outcomes from the DUETTE Trial. J Ocul Pharmacol Ther. 2018;34(7):538-542. doi:10.1089/jop.2018.0036.
- Vold S, Ahmed IIK, Craven ER, et al. Two-Year COMPASS Trial Results: Supraciliary Microstenting with Phacoemulsification in Patients with Open-Angle Glaucoma and Cataracts. Ophthalmology. 2016;123(10):2103-2112. doi:10.1016/j.ophtha.2016.06.032.
AUTOR

Néstor Ventura Abreu
MD – FEBO
Hospital Universitario Fundación Jiménez Díaz
Madrid, España