El concepto disfotopsia negativa (DN) hace referencia a la percepción por parte del paciente de un creciente marrón oscuro o negro en el campo visual temporal periférico tras el implante en el saco capsular de una lente intraocular de cámara posterior (PC IOL)(1). El término fue descrito por Davison en el año 2000(2).
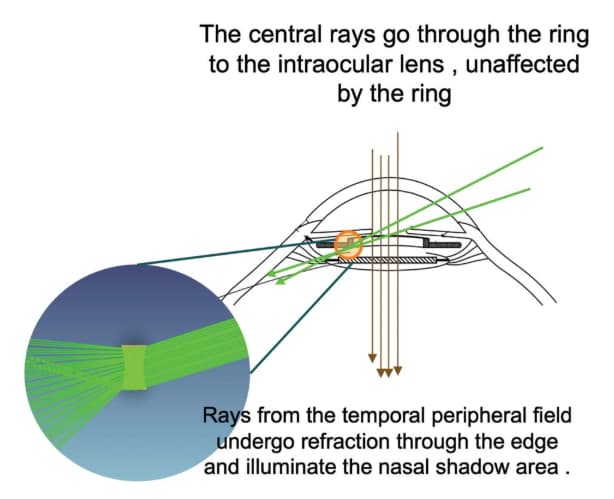
En la «extrema» periferia de la retina, sobre un ángulo de campo visual de 80 grados, la imagen se forma a partir de 2 trayectorias ópticas; es decir, rayos que son refractados por la lente intraocular (LIO) y los que no son refractados por la LIO. Si hay una brecha entre estas 2 imágenes retinianas, se percibe como una sombra oscura causando la DN(3).
Como decimos, la DN se manifiesta por el paciente como una media luna oscura en el campo visual temporal, y los pacientes comúnmente afirman que los síntomas son similares a llevar anteojeras de caballos(1). La clínica empeora bajo condiciones fotópicas, y se produce una aparente reducción en el tamaño del arco percibido cuando el ojo afectado se abduce, es decir, cuando el ojo mira en la dirección del arco(4).
TIPOS
Las disfotopsias pueden considerarse de dos tipos:
- Positivas: Consisten en artefactos brillantes, como arcos, rayas, anillos o halos en la retina central o en la periferia no extrema(5).
- Negativas: son la ausencia de luz en ciertas porciones de la retina que se manifiestan como una sombra oscura(5).
Las disfotopsias positivas, se caracterizan por imágenes ópticas no deseadas y es probablemente inducido por las propiedades de la LIO, mientras que la causa de la DN se ha mantenido especulativa(1). Aunque las disfotopsias positivas suelen ser más comunes, las negativas representan un mayor reto por su mayor persistencia(6, 7).
EPIDEMIOLOGÍA
La incidencia varía de 0.2% a 15.2% en el primer día postoperatorio, disminuyendo a 2.4% a los 2 años(2). Aproximadamente el 2‒3% de los pacientes se quejan de síntomas permanentes, pudiendo requerir procedimientos invasivos, como por ejemplo, recambios de LIO(8).
La incidencia reportada en la literatura es muy variable, oscilando entre, un 0,2% (14 de 6.668 casos) en el artículo de Davison y cols(2), pasando por un 19,5% (117 de 600 pacientes) durante el primer seguimiento en el trabajo de Bournas y cols(9), hasta un 77.7% de un total de 111 pacientes que se sometieron a cirugía de cataratas sin complicaciones en el estudio de Shambu y cols(10).
ETIOLOGÍA
El mecanismo causal de las DN se ha mantenido como un enigma clínico y no hay una teoría universalmente aceptada sobre su etiología. Se han propuesto cuatro factores primarios que determinan la presencia de este desorden, por lo que se deduce que es de origen multifactorial(4).
- Material de la LIO con un alto índice de refracción (acrílico) y ópticas con un borde afilado o truncado(2, 11, 52).
- Posición de la superficie anterior de la LIO más de 0.46 mm del plano del iris posterior(12).
- Tamaño pupilar pequeño(7, 53).
- Reflexión del borde de la capsulotomía anterior proyectado sobre la retina periférica nasal(13).
Los primeros informes de DN se observaron después de la adopción generalizada del diseño de LIO de óptica cuadrada, que evitaba la opacificación de la cápsula posterior, a mediados de la década de 1990. Davison(2) concluyó que era este diseño de borde particular y el material acrílico con su índice de refracción más alto (1.44 a 1.55) en comparación con la silicona (1.41 a 1.46) que predispone a DN. Posteriormente, otros autores apoyaron esta misma teoría(9, 11, 12, 14, 15, 16, 17, 18, 52).
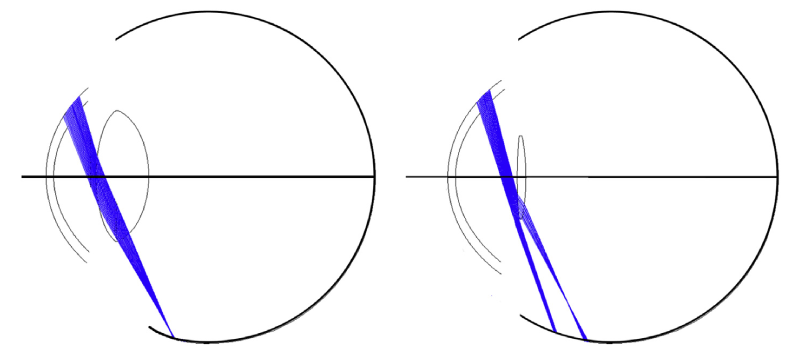
Aunque los anteriores fueron principalmente estudios observacionales, este mecanismo causal se exploró más adelante mediante un modelo de trazado de rayos por Holladay y cols.(7), Hong y cols.(19) y Simpson(20). Los cálculos realizados por Holladay revelaron que puede producirse una interrupción de los rayos de luz porque los rayos que llegan al borde posterior de la LIO, afilado o truncado, se refractarán en la retina de manera posterior que los rayos que pasan a través de la superficie de la LIO inmediatamente adyacente al borde. Los experimentos de trazado de rayos también demostraron que si el borde de la LIO es redondo, dispersará los rayos de luz, borrando así la sombra y dificultando su percepción. Sin embargo, se observó que las LIO de bordes redondeados también podrían conducir a DN siempre que el radio de la esquina del borde sea menor a 0.05 mm, lo que conduce a una disminución de la dispersión(7).
También es evidente que las LIO de mayor diámetro (oval o redondo) no necesariamente reducen o eliminan la interrupción de los rayos de luz, como se ha encontrado clínicamente(21), porque una LIO de mayor diámetro afectaría a los rayos refractados de manera similar y movería la brecha, pero no necesariamente la reduciría(3).
De igual modo, ya se sospechaba, según la experiencia clínica, que una mayor distancia entre la parte posterior del iris y la superficie anterior de la lente predispone a DN(12, 22, 23). De hecho, Holladay y cols. calcularon que el rango de distancia que permite la sombra es significativamente mayor para las LIO acrílicas (0.06 a 1.23 mm) en comparación con las LIO de silicona (0.06 a 0.62 mm)(7). Por lo tanto, es más probable que una LIO de índice de refracción más alto resulte en DN en comparación con una LIO de índice de refracción más bajo.
Por el contrario, Masket y Fram afirmaban que la causa de DN es la posición de la LIO dentro del saco capsular, subyacente a la capsulorrexis anterior(1). Éstos sugirieron, apoyados por Burke y Benjamin, que la DN probablemente ocurre fruto de la interfase de la capsulorrexis anterior y la superficie anterior de la LIO: el borde de la capsulotomía anterior refleja sobre la parte periférica de la retina nasal y forma una sombra(1, 4). La opacificación de la cápsula a lo largo del tiempo explica la reducción del 84% de las DN del segundo al tercer año después de la cirugía(3). Holladay y cols. explicaron una posibilidad alternativa a la resolución de la DN al cabo de ese tiempo, y es el movimiento hacia adelante que se produce debido a la contracción de la bolsa capsular que mueve la sombra anteriormente al borde de la retina funcional(7). Es decir, el desarrollo y manejo de este desorden no están relacionados con el tipo de LIO, sino con su posicionamiento(1). Sin embargo, en un estudio realizado por Vamosi et al.(12), el intercambio de LIO con un material y diseño diferentes no logró aliviar síntomas cuando se realizó dentro del saco capsular, y solo mejoraron si la nueva LIO se colocaba en el surco ciliar. Holladay y cols. estuvieron en contra de esta afirmación, ya que la DN es posible siempre que el espacio detrás del iris supere los 0.06 mm, lo que puede ocurrir incluso con la LIO en el surco ciliar(7).
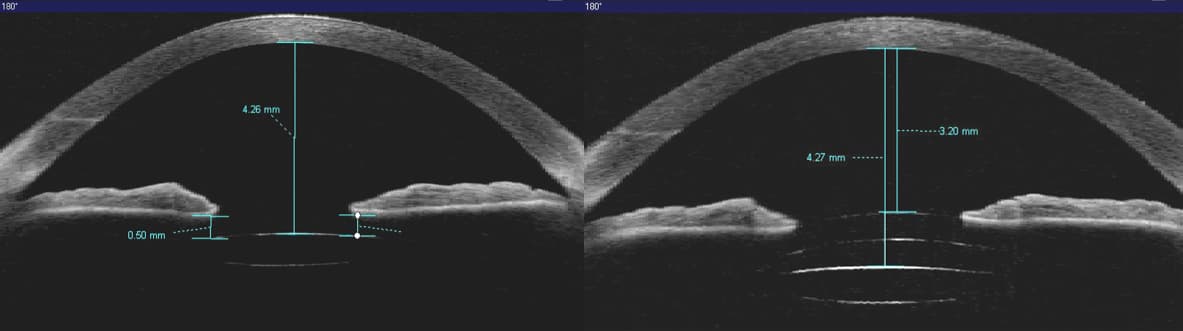
Además, es importante tener en cuenta que las LIOs disponibles en el mercado no se dividen simplemente en las dos categorías de bordes afilados y redondos; existen LIO de borde anterior redondeado y borde posterior cuadrado(24) y también LIO multifocales que han producido DN, como lo muestran DeVries y cols en su trabajo(25).
Los cálculos teóricos de trazado de rayos de Holladay y cols.(7) y los de Hong y cols.(26) mostraron que las pupilas más pequeñas, además de las bolsas capsulares transparentes y la capsulorrexis pequeña, aumentan la posibilidad de desarrollar DN.
Finalmente, se ha observado que las DN se desarrollan utilizando todo tipo de lentes, incluidas las que tienen un índice de refracción bajo y bordes redondeados. Y aunque el diseño de la LIO y la refracción del material de la LIO probablemente desempeñan un papel importante, parece que hay factores de riesgo adicionales que determinan la etiología de la DN. Aun así, no ha sido reportado en la literatura publicada ningún caso de DN con la LIO ubicada en la cámara anterior.
DIAGNÓSTICO
Una vez sospechado el cuadro clínico en nuestros pacientes nos gustaría confirmarlo, pero hasta la fecha no se ha publicado aún un criterio uniforme para el diagnóstico(27), por lo que el diagnóstico de las DN es puramente clínico. De forma típica, aparece poco después de la cirugía, a menudo al día siguiente. La queja fundamental, de nuevo, es la aparición de una sombra en su campo de visión periférico temporal, que puede ser percibido más o menos intensamente en función de la dirección de la mirada(28).
Algunos datos que nos pueden ayudar al diagnóstico de la disfotopsia son(27).
- Es una sombra molesta en el campo de visión temporal tras cirugía de catarata e implante de lente intraocular.
- No existe patología ocular que justifique esta sombra.
- El paciente suele referirse a esa sombra como si estuviera en la periferia lejana, en torno a 60º-90º. Sin embargo, usando pruebas objetivas como la campimetría, esta sombra suele estar en torno a las 10º-25º del campo de visión temporal.
- La sombra a menudo es variable: la iluminación desde el campo temporal disminuye la sombra en la mayoría de pacientes; la corrección de defectos refractivos, incluso mínimos, disminuye la sombra en muchos casos; la colocación de las manos del examinador en los laterales de la cabeza del paciente como si fueran anteojeras de caballo puede disminuir la clínica en muchos casos; al explorar al paciente en visión monocular, la clínica puede mejorar.
El escotoma temporal puede ser objetivado en ocasiones en un campo visual computarizado, lo que nos da una prueba diagnóstica más objetiva. El campo visual no cambia tras cirugía de catarata en paciente sin síntomas de DN, mientras que puede mostrar o bien una reducción concéntrica o un escotoma relativo temporal en pacientes con DN(29).
PREVENCIÓN
Podemos plantearnos dos situaciones diferentes en cuanto a la prevención de dicho fenómeno fótico: la prevención primaria, es decir, evitar el trastorno o problema, y la prevención secundaria, que hace referencia a las actuaciones realizadas para impedir el problema en parte de la población que con anterioridad se ha identificado como de riesgo.
- Primaria:
Henderson realizó un estudio aleatorizado en el que comparó la incidencia de DN tras cirugía de catarata e implantación de lente en dos ejes distintos: vertical o ínfero-temporal. Cuando la lente era acrílica, la incidencia de disfotopsia era menor al implantarse la lente con el “codo” de la unión entre óptica y háptico en posición ínfero-temporal(30).
Según algunos autores, usar una lente con hápticos de plato y alinear el “codo” de la unión entre óptica y háptico entre el eje horizontal(7, 51) y el de 30º supero-nasal durante la cirugía es una medida de prevención primaria y secundaria que puede reducir el riesgo de DN(31, 52).
Otra opción es el implante de un tipo de lente desarrollada por Samuel Masket, la lente “anti-disfotopsias” Morcher 90S, que presentan una hendidura en la parte periférica de la superficie anterior de la óptica, donde se recibirá la capsulorrexis manual o capsulotomía anterior realizada con láser femtosegundo. De este modo, el borde de la óptica cubrirá el reborde de la cápsula anterior(32).
- Secundaria:
En el caso de haberse producido síntomas de DN en el primer ojo de un paciente intervenido de catarata, se pueden plantear técnicas quirúrgicas alternativas en el segundo ojo, como pueden ser la captura inversa de la óptica, el piggyback o la implantación de LIO de tres piezas en sulcus. Todas ellas se describen a continuación como parte del tratamiento.
TRATAMIENTO
Resulta imposible predecir quiénes de nuestros pacientes con una cirugía de catarata perfecta sufrirá este fenómeno. La pregunta es, ¿Cuándo tratar? Fundamentalmente, si los síntomas son severos o no disminuyen a lo largo del tiempo.
- Observación:
La primera opción, y más sencilla es la observación. Por un lado, debe explicarse al paciente que, en la mayoría de los casos, los síntomas tienden a desaparecer por un proceso de neuroadaptación, y que debe intentar no concentrarse en ello. Por otro lado, el uso de gafas de sol puede ayudar, especialmente en la conducción, así como las gafas con monturas gruesas, aunque esta es una opción que los pacientes muchas veces rechazan(33). Además, durante los primeros 6 a 12 meses, se inicia la opacificación de la cápsula posterior, lo que elimina o al menos disminuye los síntomas de las DN(7, 26, 34).
- Colirios midriáticos:
Es una estrategia poco agresiva, pero no es una buena solución a largo plazo. Estos fármacos pueden producir dificultades en la lectura y dificultades en la visión nocturna.
- Captura inversa de la óptica:
Es uno de los métodos preferidos no solamente para corrección sino también para prevención de las DN. La técnica consiste en liberar la superficie de la óptica de la cápsula anterior del cristalino mediante viscodisección y elevar la óptica con una espátula o similar. Como requisito, exige que la capsulotomía anterior no sea ni demasiado pequeña ni rígida tras la fibrosis postoperatoria. Por tanto, podemos considerar la captura inversa de la óptica como medida profiláctica en segundos ojos de pacientes con síntomas significativos de DN en el primer ojo operado de catarata.
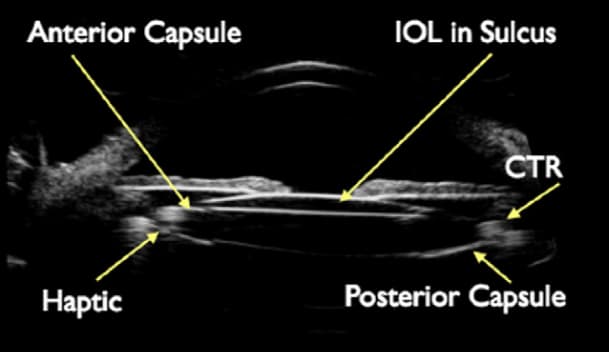
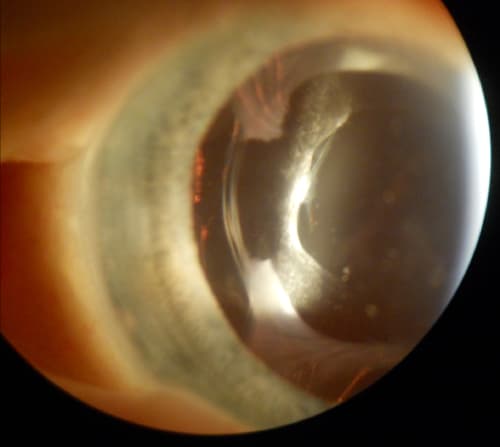
Figura 7. Imagen obtenida con BMU: muestra una captura inversa de óptica con la óptica colocada deliberadamente en el sulcus, anterior al borde de la capsulorrexis y con hápticos en el saco capsular. Esta estrategia fue descrita en primer lugar por Masket y Fram, presentando 3 casos en los que en 2 se luxó la óptica por completo a cámara anterior y en el otro solo de forma parcial (zona nasal), con mejoría en todos ellos(35). Estos resultados se han replicado posteriormente por los mismos y otros autores, e incluso se han dejado lentes con ópticas capturadas anteriormente en ojos de pacientes que ya habían experimentado DN en su primer ojo intervenido(36).
- Colocación horizontal de la lente:
Otra opción que se ha sugerido es colocar la orientación de hápticos a las 3 y a las 9 hrs, es decir, de forma horizontal lo que en teoría produce una menor incidencia de las DN en el postoperatorio inicial. Sin embargo, estos resultados no han sido replicados de forma consistente(30, 52).
- Capsulotomía anterior con Nd:YAG:
Otra de las opciones incluye romper el área nasal de la cápsula anterior con láser Nd:YAG. Este procedimiento produce una discreta anteriorización de la lente, lo que reduce la entrada de luz hacia el borde de la lente. Los resultados son variables: el éxito llega hasta un 50% en algunos trabajos(37). Presenta el inconveniente de que recambiar posteriormente la lente si esta táctica no funcionara, será más complejo, y esto debe advertirse al paciente.
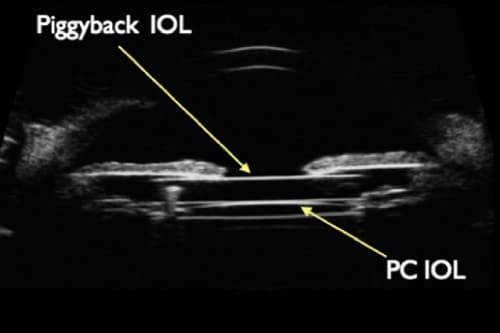
- PIGGYBACK:
Una opción terapéutica planteada es el implante de una segunda lente en el sulcus (piggyback) de un paciente con DN, consiguiendo de este modo tres objetivos:
- Resulta en una disminución de la distancia iris-LIO.
- La capsulorrexis queda cubierta por la lente.
- Se provee otra superficie para la reflexión interna que se espera genere más scattering o dispersión de los rayos de luz incidentes en el borde de la lente.
Este abordaje ha sido validado por diversos cirujanos: Ernest(35) reportó una cirugía exitosa mediante piggyback, Masket y Fram(36) describieron 7 casos, y Makhotkina(38) describió otros 9 casos. Además, un amplio número de cirujanos ratificó su acuerdo con el abordaje de piggyback en comentarios publicados y revisiones(29, 39, 40). Los experimentos mediante Ray-Tracing de Hong y cols.(26) y Holladay y cols.(7) también están de acuerdo. La expectación generada con este abordaje incluso ha sido propuesta como una medida preventiva en ojos de alto riesgo, tales como cirugía en el segundo ojo de un paciente que desarrolló DN en el primero(41). Sin embargo, algunos cirujanos dudan de su utilidad ya que puede llevar al descentramiento de la LIO o al roce con el iris, desencadenando un síndrome de dispersión pigmentaria(42, 43).
Como se ha comentado previamente, Masket y Fram introdujeron la idea de que las DN fueran causadas por una reflexión del borde de la capsulotomía anterior que es proyectada hacia la porción periférica de la retina nasal. En su artículo presentaron numerosos casos de DN que fueron satisfactoriamente tratadas, con resolución parcial o completa, colocando una lente en piggyback o por captura inversa de la óptica, mientras que no había mejoría en los síntomas si la segunda lente implantada se encontraba en el saco capsular o si se realizaba una sutura del complejo saco-lente al iris. Este estudio proporcionó evidencia de la necesidad de que la óptica de la lente se situara anterior al borde capsular para prevenir o tratar las DN. Además, los autores concluyeron que el hecho de reducir la profundidad de la cámara posterior no era suficiente para prevenir las DN en el explante de lente, como tampoco lo fue el uso de LIOs con índices de refracción más bajos(35).
- Explante:
Resulta la opción más invasiva. Para ello se debe elegir una nueva lente que tenga menos posibilidades de producir el fenómeno de DN. Las más recomendadas serían las de bordes redondeados y de silicona(44, 45) o la Morcher 90S. Aunque también se han dado casos en los que se han resuelto las DN de forma satisfactoria con lentes acrílicas de bordes cuadrados(4, 46, 52).
Por este motivo, Masket y Fram, sugieren que no se trata del diseño de la lente, sino de la localización de la misma, siendo el posicionamiento de la óptica en sulcus protector frente a este fenómeno. De hecho, en varias publicaciones se demuestra cómo tras un recambio de lente, con colocación de la nueva en sulcus, se solucionan las DN(4, 47, 47, 48, 49, 52).
- Lente en sulcus y sutura de lente a iris:
Esta estrategia quirúrgica puede emplearse bien como tratamiento, bien como prevención en segundos ojos de pacientes con DN en el primer ojo operado. La técnica implica la colocación de una lente de tres piezas en el surco ciliar(4). De igual modo, se puede suturar el complejo saco-lente en saco (hápticos) al iris para reducir la profundidad de la cámara posterior. Ambas técnicas tratan de anteriorizar la LIO, moviendo la sombra que genera DN más anteriormente alejándola de la retina nasal funcional, evitando así los síntomas en el paciente.
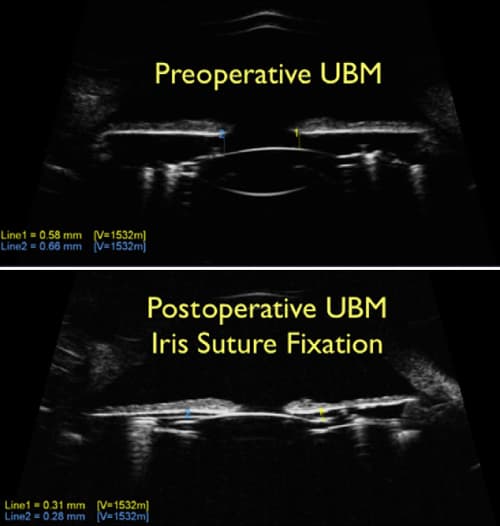
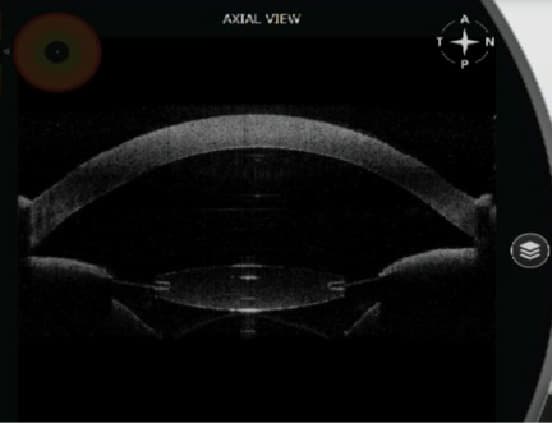
Figura 11. Imagen obtenida mediante biomicroscopía ultrasónica pre y postoperatoria. Muestra una reducción de la profundidad de la cámara posterior tras la fijación mediante sutura al iris del complejo saco-lente, en un ojo que tuvo un recambio de lente infructuoso tras implantar una LIO en saco con debilidad zonular. 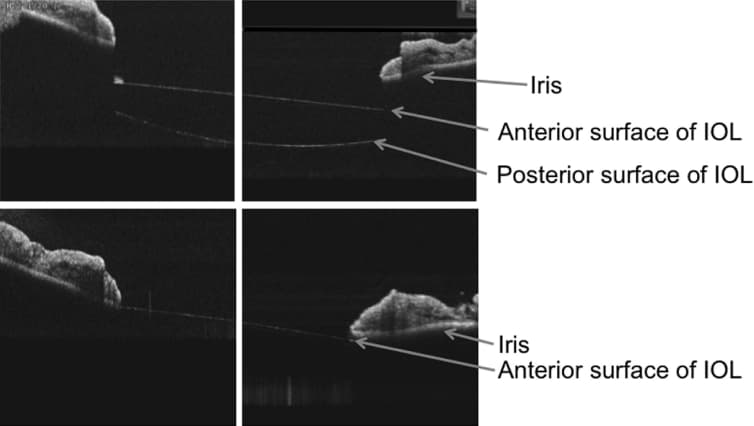
Figura 12. OCT de segmento anterior. Columna derecha e izquierda coincidentes con posición de LIO de 3 y 9 horas respectivamente. Las imágenes superiores fueron obtenidas tras facoemulsificación con implante de LIO en saco capsular. Las imágenes inferiores son obtenidas tras explante de LIO con implante secundario de LIO en sulcus ciliar. Apréciese la marcada reducción de distancia iris-LIO, prácticamente en contacto. - Truncamiento de la óptica:
Otra alternativa especialmente útil en paciente con LIO tórica y DN, podría ser recortar la óptica en su zona nasal. Se luxa con viscoelástico cohesivo la LIO por encima de la rexis y con una tijera de 19G se recorta con un ligero ángulo el reborde nasal de la óptica unos 4.5 mm de extensión, con un máximo de 0.5 mm de diámetro total de lente. Se extrae el fragmento recolocando la lente en saco capsular(50).
- Implante de anillo de disfotopsia negativa:
El ND Ring es un prototipo de dispositivo especialmente diseñado para el implante en sulcus de un ojo pseudofáquico con una lente de cámara posterior en saco capsular. Tiene un tamaño total de 12.8mm y un diámetro interno de 5 mm. Está hecho de un material acrílico hidrofílico con una forma bicóncava en su sección que diverge la incidencia de la luz en su borde interno, de tal manera que distribuye los haces de luz en el área de sombra de disfotopsia negativa. Se puede implantar como prevención primaria o profiláctica (en ojos adelfos de primeros ojos con DN), o secundaria o terapéutica (en casos activos de DN)(54).
CONCLUSIONES
Como resumen de todo ello, podemos decir que las DN son un fenómeno fótico que cursa con una media luna o mancha marrón oscura en el campo visual temporal más periférico, tras cirugía de catarata con implante de lente intraocular en saco capsular. Su incidencia es variable, pero en el 2‒3% de los pacientes los síntomas persisten, pudiendo requerir procedimientos invasivos para solucionarlo.
Su mecanismo causal se ha mantenido como un enigma clínico y no hay una teoría universalmente aceptada sobre su etiología. Se han propuesto varios factores como causa de este desorden, por lo que se considera que es de origen multifactorial. Como principal factor etiológico se encuentra el solapamiento de la capsulorrexis con la cara anterior de la LIO. Otros postulados son el implante de LIO acrílica (mayor índice de refracción) de borde cuadrado en saco capsular, una mayor distancia entre la parte posterior de iris y superficie anterior de la LIO, y pupilas pequeñas.
No existe un gold standard para el diagnóstico por lo que debe ser una conclusión según las manifestaciones clínicas del paciente, aunque la campimetría podría ser de utilidad en algunos casos. No obstante, para prevenir las DN se sugiere el uso de LIOs con plataforma de plato o la colocación de las LIOs con la unión óptica-háptico en eje infero-temporal, y en caso de haberse apreciado dichos síntomas en el primer ojo operado, se podría plantear en la cirugía del segundo ojo una captura inversa de la LIO, la implantación de una LIO de tres piezas en sulcus o un piggyback.
Cuando los síntomas son severos o perduran en el tiempo se puede plantear actuar sobre las hipotéticas causas. Las medidas más conservadoras son la observación y la instilación de colirios midriáticos de uso temporal y limitado, pudiendo realizarse una capsulotomía anterior nasal con Nd:YAG y la captura inversa de la óptica para superponer la óptica a la capsulorrexis/capsulotomía. Como medidas más agresivas: el piggyback, para situar la óptica de la lente por encima de la cápsula anterior; y el explante de LIO con colocación de LIO en surco ciliar para disminuir la distancia entre cara posterior de iris y superficie anterior de lente, al mismo tiempo que situarla por encima de la cápsula anterior.
REFERENCIAS
- Masket S, MD, Nicole R. Fram, MD. Pseudophakic negative dysphotopsia: Surgical management and new theory of etiology. J Cataract Refract Surg 2011; 37:1199-1207.
- Davison JA. Positive and negative dysphotopsia in patients with acrylic intraocular lenses, J. Cataract Refract. Surg. 2000; 26(9): 1346-1355.
- Jack T. Holladay, MD, MSEE, Michael J. Simpson, PhD. Negative dysphotopsia: Causes and rationale for prevention and treatment. Laboratory Science 2017; 263-275.
- Burke TR, Benjamin L. Sulcus-fixated intraocular lens implantation for the management of negative dysphotopsia. J Cataract Refract Surg 2014; 40:1469-1472.
- Jack T. Holladay, MD, MSEE, Huawei Zhao, PhD, Carina R. Reisin, PhD. Negative dysphotopsia: Theenigmatic penumbra. J Cataract Refract Surg 2012; 38:1251-1265.
- Henderson BA, Geneva II. Negative dysphotopsia: a perfect storm. J Cataract Refract Surg. 2015; 41:2291-2312.
- Holladay JT, Zhao H, Reisin CR. Negative dysphotopsia: Theenigmatic penumbra. J Cataract Refract Surg. 2012; 38:1251-1265.
- Ivayla I. Geneva, MD, PhD, and Bonnie A. Henderson, MD. The Complexities of Negative Dysphotopsia. Asia-Pac J Ophthalmol. 2017; 6:364-371.
- Bournas P, Drazinos S, Kanellas D, Arvanitis M, Vaikoussis E. Dysphotopsia after cataract surgery: comparison of four different intraocular lenses. Ophthalmologica 2007; 221(6): 378-383.
- Shambhu S, Shanmuganathan VA, Charles SJ. The effect of lens design on dysphotopsia in different acrylic IOLs. Eye (Lond). 2005; 19(5): 567-570.
- Radford SW, Carlsson AM, Barrett GD. Comparison of pseudophakic dysphotopsia with Akreos Adapt and SN60-AT intraocular lenses. J Cataract Refract Surg 2007; 33:88-93.
- Vamosi P, Csakany B, Nemeth J. Intraocular lens exchange in patients with negative dysphotopsia symptoms. J Cataract Refract Surg 2010; 36:418-424.
- Gosala S. Optical phenomena causing negative dysphotopsia [letter]. J Cataract Refract Surg 2010; 36:1620; reply by DL Cooke, 1620-1621.
- Narvaez J, Banning CS, Stulting RD. Negative dysphotopsia associated with implantation of the Z9000 intraocular lens. J Cataract Refract Surg 2005; 31:846-847.
- Wei M, Brettell D, Bhardwaj G, et al. Negative dysphotopsia with spherical intraocular lenses. J Cataract Refract Surg. 2010; 36:1621.
- Osher RH. Negative dysphotopsia: long-term study and possible explanation for transient symptoms. J Cataract Refract Surg. 2008; 34: 1699-1707.
- Wenzel M, Menapace R, Eppig T, et al. Is the memory effect of the blind spot involved in negative dysphotopsia after cataract surgery? J Ophthalmol. 2015; 2015:579-786.
- Simpson MJ. Managing and understanding negative dysphotopsia. J Cataract Refract Surg. 2015; 41:477.
- Hong X, Liu Y, Karakelle M, et al. Negative dysphotopsia: differences in the studies of anenigmatic optic phenomenon. J Cataract Refract Surg. 2013; 39:484-485.
- Simpson MJ. Double image in far peripheral vision of pseudophakic eye as source of negative dysphotopsia. J Opt Soc Am A Opt Image Sci Vis. 2014; 31:2642-2649.
- Masket S, Rubin D, Fram NR. Dysphotopsia and oval intraocular lenses. J Cataract Refract Surg 2016; 42:635-636.
- Weinstein A. Cataract surgical problem: April consultation #8. J Cataract Refract Surg. 2005; 31:656-657.
- Fishkind WJ. Cataract surgical problem: June consultation #3. J Cataract Refract Surg. 2006; 32:908-909.
- Nanavaty MA, Spalton DJ, Boyce J, et al. Edge profile of commercially available square-edged intraocular lenses. J Cataract Refract Surg. 2008; 34: 677-686.
- De Vries NE, Webers CA, Touwslager WR, et al. Dissatisfaction after implantation of multifocal intraocular lenses. J Cataract Refract Surg. 2011; 37:859-865.
- Hong X, Liu Y, Karakelle M, et al. Ray-tracing optical modeling of negative dysphotopsia. J Biomed Opt. 2011; 16:125001.
- Wenzel M, Langenbucher A, Eppig T. Causes, Diagnosis and Therapy of Negative Dysphotopsia. Klin Monatsbl Augenheilkd 2017. DOI: 10.1055 / s-0043-112855.
- Geneva IL, Henderson BA. The complexities of Negative Dysphotopsia. Asia-Pac J Ophthalmol 2017; 6:364-371.
- Makhotkina NY, Berendschot TT, Nuijts RM. Objective evaluation of negative dysphotopsia with Goldmann kinetic perimetry. J Cataract Refract Surg. 2016 Nov; 42(11):1626-1633.
- Henderson BA, Yi DH, Constantine JB, Geneva II. New preventative approach for negative dysphotopsia. J Cataract Refract Surg. 2016; 42:10:1449-1455.
- Holladay JT, Simpson MJ. Negative dysphotopsia: Causes and rationale for prevention and treatment. J Cataract Refract Surg. 2017; 43:263-275.
- Masket S. Development of an anti-dysphotopic IOL, Expert Review of Ophthalmology. 2018. DOI: 10.1080/17469899.2018.1560263.
- Mahar PS. Negative dysphotopsia after uncomplicated phacoemulsiphication. Pak J Ophthalmol. 2013; 29:53-56.
- Marques FF, Marques DM. Unilateral dysphotopsia after bilateral intraocular lens implantation using the AR40e IOL model: case report. Arq Bras Oftalmol. 2007; 70:350-354.
- Masket S, Fram NR. Pseudophakic negative dysphotopsia: surgical management and new theory of etiology. J Cataract Refract Surg. 2011; 37: 1199-1207.
- Masket S, Fram NR, Cho A, Park I, Pham D. Surgical management of negative dysphotopsia. J Cart Refract Surg. 2018; 44(1):6-16.
- Folden DV. Neodymium:YAG laser anterior capsulectomy: surgical option in the management of negative dysphotopsia. J Cataract Refract Surg. 2013 Jul; 39(7):1110-1115.
- Makhotkina NY, Berendschot TT, Beckers HJ, et al. Treatment of negative dysphotopsia with supplementary implantation of a sulcus-fixated intraocular lens. Graefes Arch Clin Exp Ophthalmol. 2015; 253:973-977.
- Arnold PN. Cataract surgical problem: June consultation #6. J Cataract Refract Surg. 2006; 32:910-912.
- Bellucci R. Cataract surgical problem: June consultation #2. J Cataract Refract Surg. 2006; 332-908.
- Fine H. Cataract surgical problem: June consultation #7. J Cataract Refract Surg. 2006; 32:912.
- Ernest PH. Severe photic phenomenon. J Cataract Refract Surg. 2006; 32: 685-686.
- Davison J. Refractive surgical problem: July consultation #3. J Cataract Refract Surg. 2013; 39:1124-1125.
- Cooke DL. Negative dysphotopsia after temporal corneal incisions. J Cataract Refract Surg. 2010; 36:671-672.
- Davison JA. Clinical performance of Alcon SA30AL and SA60AT single piece acrylic intraocular lenses. J Cataract Refract Surg. 2002; 28:1112-1123.
- Taubenslag KJ, Groos EB, Parker MG, et al. Successful treatment of negative dysphotopsia with in-the-bag intraocular lens exchange using a wide ovoid IOL. J Cataract Refract Surg. 2016; 42:336-337.
- Masket S, Fram NR. Sulcus-fixated IOLs for negative dysphotopsia. J Cataract Refract Surg.2015; 41:478.
- Vamosi P, Csakany B, Nemeth J. Intraocular lens exchange in patients with negative dysphotopsia symptoms. J Cataract Refract Surg. 2010; 36: 418-424.
- Weinstein A. Surgical experience with pseudophakic negative dysphotopsia. J Cataract Refract Surg. 2012; 38:561; authorreply.
- Alapati NM1, Harocopos GJ1, Sheybani A. In-the-bag nasal intraocular lens optic truncation for treatment of negative dysphotopsia. J Cataract Refract Surg. 2016 Dec;42(12):1702-1706. doi: 10.1016/j.jcrs.2016.11.002.
- Saagar V Pamulapati 1, Jordan M Saeed 1, Nichole Pompey 1, Kayéromi D Gomez 1, Mitul R Vakharia. Randomized Controlled Trial of Intraocular Lens Orientation for Dysphotopsia. Am J Ophthalmol 2022 Nov:243:28-33. doi: 10.1016/j.ajo.2022.06.018.
- Samuel Masket 1, Nicole R Fram. Pseudophakic Dysphotopsia: Review of Incidence, Cause, and Treatment of Positive and Negative Dysphotopsia. Ophthalmology. 2021 Nov;128(11):e195-e205.doi: 10.1016/j.ophtha.2020.08.009.
- Luc van Vught 1, Gregorius P M Luyten, Jan-Willem M Beenakker. Distinct differences in anterior chamber configuration and peripheral aberrations in negative dysphotopsia. J Cataract Refract Sur. 2020 Jul;46(7):1007-1015. doi: 10.1097/j.jcrs.0000000000000206.
- Prakhyat Roop, MD, Shreya Nayak, MD, Amogh Kittur, MD, Roop Roop, MD, Namrata Sharma, MD. Evaluation of a new device to treat negative dysphotopsia. J Cataract Refract Surg 2024; 50:122–127
AUTORES

Dr. Iker Henares
Sección Superficie ocular y catarata.
Hospital Universitario de Basurto, Bilbao, España.

Dra. Estibaliz Ispizua
Hospital de Urduliz, España.

Dr. Pablo Rivera
Hospital de Urduliz, España.

Dra. Lucía Barturen
Sección Glaucoma
Hospital Universitario de Basurto, Bilbao, España.

Dra. Naroa Moreno
Neurooftalmología
Hospital Universitario de Basurto, Bilbao, España.

Dra. Andrea Aramburu
Hospital Universitario de Basurto, Bilbao, España.