El Dr. Lopez-Marín Espigares iniciaba un nuevo hilo en el Foro FacoElche sobre el síndrome de Irvine-Gass y el aumento considerable de casos que habían detectado en su centro. Se discutieron las posibles causas, por ejemplo; el Dr. Giménez de la Linde comentó que el exceso de irrigación de la cefuroxima para hidratar las incisiones dio lugar al origen del Irvine-Gass en una serie de casos que publicaron. De esta manera, el debate fue rápidamente orientado a la prevención del Irvine-Gass, pues la mayoría de las veces es difícil conocer la causa si partimos de pacientes sin comorbilidades asociadas y tras una cirugía de cataratas sin complicaciones. El Dr Giménez de la Linde reconduce el hilo del debate hacia cuál es el protocolo más correcto. Diferentes participantes comparten su estrategia en el protocolo de tratamiento en la cirugía de cataratas según su experiencia. Para dar fundamento crítico a este tema, el Dr. Joaquín Fernández comparte un análisis sobre el síndrome de Irvine-Gass tras analizar los resultados del estudio PREMED y la Evaluación Tecnológica de la AAO. No obstante, parece ser que el tratamiento tras la cirugía de cataratas para evitar el Irvine-Gass aún no está claramente consensuado como refleja el Dr. Fernando Soler compartiendo un artículo reciente a través del foro.
A propósito de este hilo, hemos decidido realizar este FacoBlog para hacer una revisión de la literatura publicada sobre la prevención del edema macular postquirúrgico (Irvine-Gass).
INTRODUCCIÓN
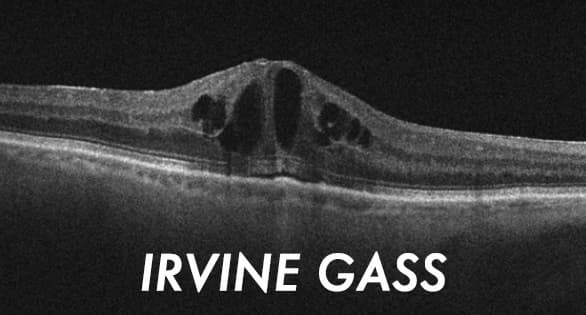
El Edema Macular Cistoide (EMC) postoperatorio sigue siendo una de las complicaciones más frecuentes de la cirugía intraocular. Se define como la presencia de espacios de líquido intrarretiniano o engrosamiento macular central en el examen de tomografía de coherencia óptica (OCT) (Fig. 1).1
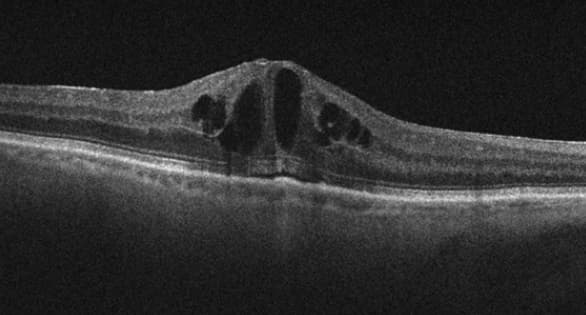
El síndrome de Irvine-Gass, a veces llamado, EMC pseudofáquico, es un edema macular cistoide que se desarrolla después de una cirugía de cataratas sin incidentes. Fue descrito por primera vez en 19532 y, discutido más tarde por Gass y Norton en 19663. El síndrome de Irvine-Gass sigue siendo la causa más común de disminución de la agudeza visual después de una cirugía de cataratas sin incidentes.4
CONCEPTO E INCIDENCIA
La incidencia del Irvine-Gass varía según la definición usada y el estudio revisado.5 Puede ser definido angiográficamente (fuga de contraste), clínicamente (engrosamiento macular observado en la biomicroscopía asociado a una disminución de agudeza visual) o basado en la Tomografía de Coherencia Óptica (OCT) como un engrosamiento de fluido entre la capa nuclear interna y plexiforme externa, asociado o no a fluido subretiniano.6
El EMC pseudofáquico clínicamente significativo que afecta la visión de los pacientes se encuentra entre el 1-2% de los pacientes, con una incidencia máxima a las 6 semanas después de la cirugía, pero el EMC subclínico se puede ver en aproximadamente el 30% de los pacientes en angiografía y hasta en el 40% en OCT.7
FISIOPATOLOGÍA
Se sugiere, como causa de este EMC, la disrupción de la barrera hemato-retiniana interna procedente de la cascada inflamatoria desencadenada por la cirugía, incrementando la permeabilidad capilar que resulta en la acumulación de fluido en las capas retinianas.8
Entre las causas que pueden favorecer la activación de la cascada proinflamatoria, además del mecanismo traumático de la propia cirugía, se ha estudiado la asociación de las prostaglandinas8 o el exceso de irrigación con cefuroxima intracamerular a la aparición del EMC postquirúrgico.9
No obstante, en muchas ocasiones no se encuentra una causa directa que justifique su aparición, más allá que la propia cirugía como mecanismo traumático10 y, por tanto, la mayoría de los estudios se han enfocado en la prevención del Irvine-Gass, centrada en frenar la cascada proinflamatoria desencadenada tras la cirugía de cataratas.
Para ello existen dos clases de medicamentos, los antiinflamatorios no esteroideos (AINE) y los corticoesteroides.
PREVENCIÓN DEL EMC TRAS CIRUGÍA DE CATARATAS: AINES Y CORTICOESTEROIDES
Los anti-inflamatorios no esteroideos (AINEs)
Los AINE actúan bloqueando las enzimas ciclooxigenasa (COX), COX-1 y COX-2, reduciendo o bloqueando así la producción de prostaglandinas. La enzima COX-2 es más prevalente en la respuesta inflamatoria que la COX-1, y, por lo tanto, la potencia de inhibición de la COX-2 tiende a determinar la eficacia clínica del AINE.11
Uno de los AINE vía tópica más utilizados es el Bromfenaco (Yellox®), fue modificado para hacerlo más lipófilo para mejorar la penetración en la córnea, aumentar la duración de la acción y mejorar la inhibición de la COX-2. Se ha encontrado que el Bromfenaco es hasta 18 veces más potente como inhibidor de la COX-2 que el Diclofenaco y el Ketorolaco. Además, es un inhibidor muy potente de la producción de prostaglandinas.12,13 El Bromfenaco 0.09% ha sido utilizado en varios estudios para la prevención del EMC tras la cirugía de cataratas6,14,15 reflejando una buena penetrancia ocular, una actividad antiinflamatoria duradera y una inhibición de la COX-2 mejorada, respecto a otros AINE.
El Diclofenaco (Dicloabak®, Diclofenao-lepori®) y el Ketorolaco (Acular®) tienen poca solubilidad; por lo tanto, normalmente se usan en forma de sal de sodio para aumentarlo. Además, tienen una permeabilidad limitada y debe amortiguarse a un pH más bajo (6,0) para aumentar la penetración en la córnea. Sin embargo, la disminución del pH de la solución da como resultado la precipitación y, por lo tanto, se deben usar estabilizadores.11
El Nepafenaco (Nevanac®) es un profármaco que penetra rápidamente en la córnea. Tiene una capacidad de penetración mucho mayor que el Diclofenaco. Los estudios han demostrado que el Nepafenaco puede ser más potente que el Ketorolaco o el Diclofenaco.16 Además, el Nepafenaco (Nevanac®) es el único medicamento aprobado por la Agencia Europea del Medicamento para su uso en la prevención del EMC tras cirugía de cataratas en diabéticos.
El momento óptimo para el inicio del pretratamiento sigue siendo controvertido. Se ha demostrado que la administración tópica de AINE hasta una hora antes de la cirugía reduce la inflamación postoperatoria. Por ejemplo, el tiempo para alcanzar las concentraciones acuosas máximas de Nepafenaco, Ketorolaco y Bromfenaco es de 30 minutos, 60 minutos y 240 minutos después de la instilación, respectivamente.17 Por lo tanto, el Bromfenaco requeriría un inicio más temprano del pretratamiento para lograr el efecto máximo.
Un estudio de 2006 de Donnenfeld y cols encontraron que 1-3 días de pretratamiento con Ketorolaco al 0,4 % resultó en una reducción de la EMC en comparación con el pretratamiento 1 hora antes de la cirugía de cataratas y el placebo, aunque esto no fue estadísticamente significativo.18 En este mismo estudio, los pacientes con 1-3 días de pretratamiento con Ketorolaco también disminuyó la miosis intraoperatoria, redujo el tiempo quirúrgico y la energía de facoemulsificación, disminuyó la pérdida de células endoteliales y mejoró la agudeza visual en el período posoperatorio inmediato, con una dosis-respuesta que favoreció el tratamiento de tres días.
Por lo tanto, tres días de farmacoterapia antiinflamatoria tópica antes de la cirugía de cataratas parece ser una opción práctica a considerar para la profilaxis de la inflamación y el EMC postquirúrgico, particularmente en pacientes de alto riesgo.17
Tras la comparación entre los diferentes AINEs que tenemos para prevenir el EMC postquirúrgico, parece que existen características plausibles que nos permitirían elegir unos a favor de otros. Sin embargo, los estudios comparativos no han encontrado diferencias estadísticamente significativas.15,19
Los corticoesteroides
Los corticosteroides funcionan más arriba de los AINEs, regulando transcripcionalmente la anexina y la proteína quinasa activada por mitógenos (MAPK) fosfatasa 1 que, a su vez, inhiben el metabolismo de los fosfolípidos de membrana y el estado de fosforilación de la fosfolipasa A2. Además de inhibir la fosfolipasa A2, el receptor de glucocorticoides unido a esteroides regula transcripcionalmente muchas otras cascadas inflamatorias y antiinflamatorias.20
Con respecto a la selección de corticosteroides, tenemos la Fluorometolona 0.1%, la Dexametasona 0,1% (maxidex®, dexafree®) y acetato de Prednisolona 0,1% (pred-forte®). Aunque la Dexametasona es más potente que la Prednisolona, el acetato de Prednisolona al 1% es de 2 a 3 veces más eficaz para la inflamación intraocular que la Dexametasona al 0,1 %, ya que una sola gota de acetato de Prednisolona al 1% produce una concentración acuosa de 669,9 ng/ml en comparación con una concentración de 31,0 ng/mL para dexametasona.21 Por otro lado, la Fluorometolona alcanza concentraciones acuosas incluso más bajas que la Dexametasona (5,1 ng/mL); aunque tiene una potencia similar a la Dexametasona, para la inflamación intraocular simula un placebo.21
Por tanto, es evidente que, se precisan de un mayor número de estudios controlados para evaluar el efecto de los AINEs , además de los corticosteroides, con esquemas de dosificación equilibrados. Dichos estudios deben realizar un seguimiento de la agudeza visual, no solo de EMC, como resultado primario6,22. Además, dado que los esteroides tópicos con alta penetración en el humor acuoso y vítreo deberían tener un efecto similar debido a la inhibición previa de la cascada inflamatoria, se requieren más estudios para examinar el pretratamiento con corticoesteroides20.
El uso de corticosteroides para el pretratamiento y la atención posoperatoria en lugar del tratamiento combinado con esteroides y AINE tendría varias ventajas. Reduciría la cantidad de gotas para los pacientes, lo que puede mejorar el cumplimiento y también podría resultar en un ahorro para el sistema.23
AINES Y CORTICOESTEROIDES: TERAPIA COMBINADA VERSUS MONOTERAPIA
De los estudios que comparan el uso de AINE como terapia coadyuvante a los corticoesteroides para evitar el desarrollo del EMC tras cirugía de cataratas, debemos destacar el estudio PREMED de la ESCRS y la Evaluación Tecnológica Americana.
La Evaluación Tecnológica Americana publicada en 201522, analizó los estudios publicados hasta la fecha donde se utilizaron los AINEs como parte del tratamiento tras cirugía de cataratas, obteniendo las siguientes conclusiones:
- Los AINEs son claramente efectivos para reducir la incidencia del EMC basado en la OCT y en la recuperación visual en el postoperatorio inmediato.
- No hay evidencia del uso de AINE como profilaxis para la pérdida de visión asociada al EMC postoperatorio a largo plazo (>3meses).
- No está claro si el mecanismo combinado de ambos fármacos produce un efecto sinérgico o simplemente un efecto aditivo, que podría sustituirse por un aumento de la dosis en monoterapia24,25
- Los diferentes estudios analizados, utilizan diferentes AINEs y corticoesteroides que dificulta sacar conclusiones extrapolables.
- La definición usada el EMC tras cirugía de cataratas, se basa en un incremento del 10% en el espesor macular central o en una mejoría visual menor de 0.2 logMAR (2 líneas en ETDRS) respecto a la preoperatoria. Sin embargo, muchos casos de Irvine-Gass según la OCT en este estudio NO iban asociados a un empeoramiento subjetivo de la visión.
- Algunos de los pacientes incluidos en el estudio, no presentaban reducción visual, sino en la calidad de la misma. Por lo que en el resultado postoperatorio no se encontró una mejoría visual, y sin embargo, fueron clasificados como caso.
- En cuanto a la mejor agudeza visual corregida (MAVC), no se encontraron diferencias estadísticamente significativas a las 12 semanas entre los 3 grupos del estudio.
- En la incidencia de desarrollo de EMC postquirúrgico si se encontraron diferencias entre grupos, estudiado a las 6 y a las 12 semanas del postoperatorio, siendo menor en el grupo con terapia combinada, seguido del grupo con Bromfenaco, y por último, el grupo de Dexametasona.
- Grzybowski A, Sikorski BL, Ascaso FJ, Huerva V. Pseudophakic cystoid macular edema: Update 2016. Clin Interv Aging. 2016; 11:1221–9.
- Irvine SR. A Newly Defined Vitreous Syndrome Following Cataract Surgery*. Am J Ophthalmol [Internet]. 1953;36(5):599–619. Available from: http://dx.doi.org/10.1016/0002-9394(53)90302-X
- GASS JDM. Cystoid Macular Edema and Papilledema Following CataractExtraction. Arch Ophthalmol.1966;76(5):646.
- Henderson BA, Kim JY, Ament CS, Ferrufino-Ponce ZK, Grabowska A, Cremers SL. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg. 2007;33(9):1550–8.
- Flach A.J. The incidence, pathogenesis and treatment of cystoid macular edema following cataractsurgery. Trans. Am. Ophthalmol. Soc. 1998; 96:557–634.
- Wielders LHP, Schouten JSAG, Winkens B, van den Biggelaar FJHM, Veldhuizen CA, Findl O, et al. European multicenter trial of the prevention of cystoid macular edema after cataract surgery in nondiabetics:ESCRSPREMED study report 1. J Cataract Refract Surg. 2018;44(4):429–39.
- Shelsta H.N., Jampol L.M. Pharmacologic therapy of pseudophakic cystoid macular edema: 2010 update. Retina. 2011; 31:4–12. doi: 10.1097/IAE.0b013e3181fd9740.
- Miyake K, Ibaraki N. Prostaglandins and cystoid macular edema. SurvOphthalmol. 2002;47(4 SUPPL. 1).
- Giménez-de-la-Linde M, Giménez-Alcántara B, Barañano-Alcaide R, Cordovés-Dorta L, Abreu-Reyes JA. Edema macular en el postoperatorio de la cirugía no complicada de la catarata. Posible relación con elvolumen de cefuroxima intracamerular. Arch Soc Esp Oftalmol. 2017;92(1):49–50.
- Taubenslag KJ, Kim SJ, Grzybowski A. Anti-inflammatory Pharmacotherapy for the Prevention of Cystoid Macular Edema After Cataract Surgery. Am J Ophthalmol [Internet]. 2021; 232:1–8. Available from: https://doi.org/10.1016/j.ajo.2021.06.009
- Hoffman RS, Braga-Mele R, Donaldson K, Emerick G, Henderson B, Kahook M, et al. Cataract surgery and nonsteroidal antiinflammatory drugs. J Cataract Refract Surg [Internet]. 2016;42(9):1368–79. Available from: http://dx.doi.org/10.1016/j.jcrs.2016.06.006
- Stewart RH, Grillone LR, Shiffman ML, Donnenfeld ED, Gow JA. The systemic safety of bromfenacophthalmic solution 0.09%. J Ocul Pharmacol Ther. 2007;23(6):601–12.
- Waterbury LD, Silliman D, Jolas T. Comparison of cyclooxygenase inhibitory activity and ocular anti-inflammatory effects of ketorolac tromethamine and bromfenac sodium. Curr Med Res Opin.2006;22(6):113340.
- Carreño E, Portero A, Galarreta DJ, Herreras JM. Update on twice-daily bromfenac sodium sesquihydrate to treat postoperative ocular inflammationfollowing cataract extraction. Clin Ophthalmol. 2012;6(1):637–44.
- Duan P, Liu Y, Li J. The comparative efficacy and safety of topical non-steroidal anti-inflammatory drugs for the treatment of anterior chamber inflammation after cataract surgery: a systematic review and network metaanalysis. Graefe’s Arch Clin Exp Ophthalmol. 2017;255(4):639–49.
- Kapin MA, Yanni JM, Brady MT, McDonough TJ, Flanagan JG, Rawji MH, et al. Inflammation-Mediated Retinal Edema in the Rabbit Is Inhibited by Topical Nepafenac. Inflammation. 2003;27(5):281–91.
- Taubenslag KJ, Kim SJ, Grzybowski A. Anti-inflammatory Pharmacotherapy for the Prevention of Cystoid Macular Edema After Cataract Surgery. Am J Ophthalmol [Internet]. 2021; 232:1–8. Available from: https://doi.org/10.1016/j.ajo.2021.06.009
- Donnenfeld ED, Perry HD, Wittpenn JR, Solomon R, Nattis A, Chou T. Preoperative ketorolac tromethamine 0.4% in phacoemulsification outcomes: Pharmacokinetic-response curve. J Cataract Refract Surg.2006;32(9):1474–82.
- Lee TH, Choi W, Ji YS, Yoon KC. Comparison of ketorolac 0.45% versus diclofenac 0.1% for macularthickness and volume after uncomplicatedcataract surgery. Acta Ophthalmol. 2016;94(3):e177–82.
- Taubenslag KJ, Kim SJ, Grzybowski A. Anti-inflammatory Pharmacotherapy for the Prevention of Cystoid Macular Edema After Cataract Surgery. Am J Ophthalmol [Internet]. 2021; 232:1–8. Available from: https://doi.org/10.1016/j.ajo.2021.06.009
- McGhee CNJ, Watson DG, Midgley JM, Noble MJ, Dutton GN, Fern AI. Penetration of syntheticcorticosteroids into human aqueous humour. Eye.1990;4(3):526–30.
- Kim SJ, Schoenberger SD, Thorne JE, Ehlers JP, Yeh S, Bakri SJ, et al. Topical Nonsteroidal Anti-inflammatory Drugs and Cataract Surgery: A Report by the American Academy of Ophthalmology. Ophthalmology [Internet]. 2015;122(11):2159–68. Available from: http://dx.doi.org/10.1016/j.ophtha.2015.05.014
- Zafar S, Wang P, Schein OD, Srikumaran D, Makary M, Woreta FA. Prescribing Patterns and Costs Associated with Postoperative Eye Drop Use in Medicare Beneficiaries Undergoing Cataract Surgery. phthalmology [Internet]. 2020;127(5):573–81. Available from: https://doi.org/10.1016/j.ophtha.2019.11.005
- Allan J. Solution and 0.1 % Dexamethasone Sodium Phosphate Solution on Postsurgical Blood-AqueousBarrier. 2015;1–4.
- An JA, Kasner O, Samek DA, Lévesque V. Evaluation of eyedrop administration by inexperienced patientsafter cataract surgery. J CataractRefract Surg. 2014;40(11):1857–61.
- European Medicines Agency. Yellox, bromfenac. First published 14/06/ 2011; updated 17/11/2017. Available at: http://www.ema.europa .eu/ema/index.jsp?curlZpages/medicines/human/medicines/001198 /human_med_001455.jsp&midZWC0b01ac058001d124. Accessed February 21, 2018
- Miyanaga M, Miyai T, Nejima R, Maruyama Y, Miyata K, Kato S. Effect of bromfenac ophthalmic solution on ocular inflammation following cataractsurgery. Acta Ophthalmol. 2009;87(3):300–5.
- Wang QW, Yao K, Xu W, Chen PQ, Shentu XC, Xie X, et al. Bromfenac sodium 0.1%, fluorometholone 0.1% and dexamethasone 0.1% for control of ocular inflammation and prevention of cystoid macular edema afterphacoemulsification. Ophthalmologica. 2013;229(4):187–94
- Gärdin J, Johansson B. Incidence of unplanned visits after cataract surgery in two large cohorts with differentanti-inflammatory treatment protocols. Acta Ophthalmol. 2022;(May):1–9.
- Cabourne E, Lau N, Flanagan D, Nott J, Bloom J, Angunawela R. Severe corneal melting after cataract surgery in patients prescribed topical postoperative NSAIDs and dexamethasone/neomycin combination therapy. J Cataract Refract Surg. 2020;46(1):138–42.
- Chu FB, Vollman DE, Apte RS, Cohen BH, Siegfried CJ, Kymes SM. An economic evaluation of prophylactic NSAID use with cataract surgery to prevent cystoid macular edema. Invest Ophthalmol Vis Sci.2010; 51:4562.
- Teo MAL, Bloch E, Muniraju R, Ursell P. Intraoperative subconjunctival steroid reduces the incidence of pseudophakic macular oedema: a cohort study of 20,066 consecutive phacoemulsification surgeries. Eye.2022;(October):1–5.
- Hermann MM, Stündag CÜ, Diestelhorst M. Electronic compliance monitoring of topical treatment after ophthalmic surgery. Int Ophthalmol.2010;30(4):385–90.
- Newman-Casey PA, Robin AL, Blachley T, Farris K, Heisler M, Resnicow K, et al. The Most Common Barriers to Glaucoma Medication Adherence: A Cross-Sectional Survey. Ophthalmology [Internet].2015;122(7):1308–16. Available from: http://dx.doi.org/10.1016/j.ophtha.2015.03.026
- Walters T, Bafna S, Vold S, et al. Efficacy and Safety of Sustained Release Dexamethasone for the Treatment of Ocular Pain and Inflammation after Cataract Surgery: Results from Two Phase 3 Studies. J Clin Exp Ophthalmol. 2016;7(4):1-11.
- Donnenfeld E, Holland E. Dexamethasone Intracameral Drug-Delivery Suspension for Inflammation Associated with Cataract Surgery: A Randomized, Placebo-Controlled, Phase III Trial. Ophthalmology. 2018;125(6):799-806.
- Tyson SL, Bafna S, Gira JP, et al. Multicenter randomized phase 3 study of a sustained-release intracanalicular dexamethasone insert for treatment of ocular inflammation and pain after cataract surgery.J Cataract Refract Surg. 2019;45(2):204-212.
- Giarmoukakis A.K., Blazaki S.V., Bontzos G.C., Plaka A.D., Seliniotakis K.N., Ioannidi L.D., Tsilimbaris M.K. Efficacy of topical nepafenac 0.3% in the management of postoperative cystoid macular edema. Ther. Clin. Risk Manag. 2020; 16:1067–1074. doi: 10.2147/TCRM.S271184.
- Guclu H., Gurlu V.P. Comparison of topical nepafenac 0.1% with intravitreal dexamethasone implant for the treatment of Irvine-Gass syndrome. Int. J. Ophthalmol. 2019; 12:258–267. doi: 10.18240/ijo.2019.02.12.
- Sengupta S., Vasavada D., Pan U., Sindal M. Factors predicting response of pseudophakic cystoid macular edema to topical steroids and nepafenac. Indian J. Ophthalmol. 2018; 66:827–830. doi: 10.4103/ijo.IJO_735_17.
- Wingert AM, Liu SH, Lin JC, Sridhar J. Non-steroidal anti-inflammatory agents for treating cystoid macular edema following cataract surgery. Cochrane Database Syst Rev. 2022;12(12):CD004239. Published 2022 Dec 15. doi:10.1002/14651858.CD004239.pub4
- Curković T., Vukojević N., Bućan K. Treatment of pseudophakic cystoid macular oedema. Coll. Antropol. 2005:103–105.
- Catier A., Tadayoni R., Massin P., Gaudric A. Intérêt de l’acétazolamide associé aux anti-inflammatoires dans le traitement de l’oedème maculaire postopératoire (Advantages of acetazolamide associated with anti-inflammatory medications in postoperative treatment of macular edema) J. Fr. Ophtalmol. 2005; 28:1027–1031. doi: 10.1016/S0181-5512(05)81134-9.
- Heier J.S., Topping T.M., Baumann W., Dirks M.S., Chern S. Ketorolac versus prednisolone versus combination therapy in the treatment of acute pseudophakic cystoid macular edema. Ophthalmology. 2000; 107:2034–2038. doi: 10.1016/S0161-6420(00)00365-1.
- Singal N., Hopkins J. Pseudophakic cystoid macular edema: Ketorolac alone vs. ketorolac plus prednisolone. Can. J. Ophthalmol. 2004; 39:245–250. doi: 10.1016/S0008-4182(04)80121-2.
- Kuley B., Storey P.P., Wibbelsman T.D., Pancholy M., Zhang Q., Sharpe J., Bello N., Obeid A., Regillo C., Kaiser R.S., et al. Resolution of pseudophakic cystoid macular edema: 2 mg intravitreal triamcinolone acetonide versus 40 mg posterior sub-tenon triamcinolone acetonide. Curr. Eye Res. 2021:1–7. doi: 10.1080/02713683.2020.1842458.
- Erden B., Çakır A., Aslan A.C., Bölükbaşı S., Elçioğlu M.N. The efficacy of posterior subtenon triamcinolone acetonide injection in treatment of irvine-gass syndrome. Ocul. Immunol. Inflamm. 2019; 27:1235–1241. doi: 10.1080/09273948.2019.1620786.
- Tsai M.-J., Yang C.-M., Hsieh Y.-T. Posterior subtenon injection of triamcinolone acetonide for pseudophakic cystoid macular oedema. Acta Ophthalmol. 2016;96:e891–e893. doi: 10.1111/aos.13200.
- Mayer WJ, Kurz S, Wolf A, Kook D, Kreutzer T, Kampik A, et al. Dexamethasone implant as an effective treatment option for macular edema due to Irvine-Gass syndrome Presented at the XXIX Club Gonin Meeting, Zurich, Switzerland, September 2014. J Cataract Refract Surg [Internet]. 2015;41(9):1954–61. Available from: http://dx.doi.org/10.1016/j.jcrs.2015.10.025
- Sharma A., Bandello F., Loewenstein A., Kuppermann B.D., Lanzetta P., Zur D., Hilely A., Iglicki M., Veritti D., Wang A., et al. Current role of intravitreal injections in Irvine Gass syndrome-CRIIG study. Int. Ophthalmol. 2020; 40:3067–3075. doi: 10.1007/s10792-020-01491-5.
- Akay F., Isik M.U., Akmaz B. Comparison of intravitreal anti-vascular endothelial growth factor agents and treatment results in Irvine-Gass syndrome. Int. J. Ophthalmol. 2020; 13:1586–1591. doi: 10.18240/ijo.2020.10.12.
- Staurenghi G., Lai T.Y.Y., Mitchell P., Wolf S., Wenzel A., Li J., Bhaumik A., Hykin P.G., PROMETHEUS Study Group Efficacy and safety of ranibizumab 0.5 mg for the treatment of macular edema resulting from uncommon causes: Twelve-month findings from prometheus. Ophthalmology. 2018; 125:850–862. doi: 10.1016/j.ophtha.2017.12.002.
- Verdina T., D’Aloisio R., Lazzerini A., Ferrari C., Valerio E., Mastropasqua R., Cavallini G.M. The role of subthreshold micropulse yellow laser as an alternative option for the treatment of refractory postoperative cystoid macular edema. J. Clin. Med. 2020; 9:1066. doi: 10.3390/jcm9041066.
- Maleki A., Aghaei H., Lee S. Topical interferon alpha 2b in the treatment of refractory pseudophakic cystoid macular edema. Am. J. Ophthalmol. Case Rep. 2018; 10:203–205. doi: 10.1016/j.ajoc.2018.03.005.
El estudio PREMED 1 de la ESCRS6 realizado entre 2013-2016 se centra en el uso, combinado o no, de AINE y corticoides para prevenir la aparición del EMC. Los pacientes fueron divididos en 3 grupos: Bromfenaco 0.9% desde 2 días antes de la cirugía hasta 2 semanas después, 2 veces al día. Dexametasona difosfato de sodio 0,1% desde 2 días antes y 1 semana después, 4 veces al día. Reducción de 1 gota al día durante 1 semana más. Y, el tercer grupo, fue tratado con una combinación de ambos en la misma pauta.
El AINE elegido fue Bromfenaco 0.09% por ser utilizados en estudios anteriores11,15. Y la Dexametasona 0.1% fue el corticoesteroide elegido por ser el utilizado en la mayoría de los centros que participaron en el estudio PREMED.
La aplicación durante 2 semanas postoperatorias del AINE, dos veces al dia, siguiendo el criterio de la Agencia Europea del Medicamento.26
Hay oftalmólogos que utilizan el AINE durante 1 ó 2 meses postoperatorio, no obstante, parece ser que no añade efectividad en aquellas cirugías de cataratas sin comorbilidades sistémicas asociadas ni enfermedades oculares previas.27,28
De las conclusiones de este estudio, podemos destacar:
En resumen, tanto el estudio PREMED 1, como la Evaluación Tecnológica Americana coinciden en que, a corto plazo, con el uso de AINE, la mejoría visual es más rápida, y la incidencia de EMC postquirúrgico diagnosticado por OCT es menor.
Sin embargo, no se encontraron diferencias en el resultado de la BCVA a largo plazo (>3 meses) en los pacientes que recibieron AINE.
No obstante, tras estas conclusiones, son varios los artículos recientemente publicados29,30 en contra del uso concomitante de AINES en el postoperatorio de la cirugía de cataratas como profilaxis del EMC, entre los argumentos que se defienden están las complicaciones postoperatorias como el melting corneal o la queratitis que genera el incumplimiento de la adherencia al tratamiento. Recientemente, un estudio del Moorfileds en el cual se utilizaron Maxitrol® y Acular® como tratamiento postoperatorio, observó una serie de casos con queratopatias atípicas que asociaron al uso combinado de los AINE junto con la neomicina y benzalconio de los colirios utilizados.30.
Por otro lado, destacan el incremento adicional del coste en el tratamiento tras la cirugía de cataratas por el uso de AINE al no encontrar un beneficio costo-efectivo en su uso.31,32
PREVENCIÓN DEL IRVINE-GASS SIN GOTAS, LO MÁS RECIENTE
Los estudios más recientes32, defienden añadir al arsenal de medicamentos antiinflamatorios tras la cirugía de cataratas, las formulaciones de esteroides «sin gotas». Sin embargo, no se compara con el uso de AINEs, los grupos estudiados son los que recibieron inyección subconjuntival de corticoesteroides y los que no la recibieron. El corticoide subconjuntival utilizado fue la betametasona o dexametasona. No se alcanzaron picos hipertensivos gracias a su solubilidad acuosa, comparado con la triamcinolona que sí se han descrito casos de hipertensión ocular tras su administración. Obtuvieron menor número de casos de EMC en el grupo tratado con corticoides subconjuntival que aquellos que no, pero sólo con resultados estadísticamente significativos en los casos complicados o con comorbilidades sistémicas de base (diabetes). Si se comparan los resultados con aquellos artículos que usaron AINES, consideran una incidencia similar de EMC.
En defensa a la administración intraoperatoria de esteroides, tenemos como ventaja la comodidad para el paciente, pues la administración frecuente de gotas para los ojos requerida en el período perioperatorio puede representar un desafío para algunos pacientes, y los programas de reducción gradual de gotas pueden generar confusión.25
Muchos pacientes citan el olvido como una barrera para el cumplimiento; otros están discapacitados o carecen de la destreza manual necesaria para administrar las gotas con éxito. El incumplimiento de los regímenes de gotas para los ojos ha sido bien documentado en la literatura sobre cataratas y glaucoma.33,34
Estudios recientes35,36,37 con productos ya aprobados por la FDA, para su implante intracameral o intracanalicular encontraron efectos antiinflamatorios prometedores, aunque ninguno de los ensayos de fase III examinó la EMC como variable principal de estudio, las tasas fueron similares a las reportadas en la literatura para los corticosteroides tópicos. Estos ensayos fueron controlados con placebo, lo que dificulta evaluar si estos sistemas de administración sin gotas no son inferiores a la atención estándar con esteroides tópicos, AINE tópicos o terapia tópica dual.37
TRATAMIENTO DEL EMC PSEUDOFÁQUICO
Actualmente, existen diferentes formas de tratamiento del Irvine-Gass una vez establecido.
1.- AINEs
Diferentes estudios muestran una mejoría funcional y morfológica del EMC pseudofáquico.38,39,40 Por ejemplo, Giarmoukakis y cols38, consiguen una mejoría visual desde 0.49 ± 0.36 logMAR a 0.36 ± 0.42 logMAR en la última visita (p < 0.005). El engrosamiento macular central se redujo desde 450.40 ± 90.74 micras de base a 354.60 ± 81.49 micras (p < 0.05). Los últimos estudios favorecen al Nepafenaco tópico en comparación con otros colirios AINEs, utilizado al 0.3%, dos veces al día durante 4 meses38 o al 0.1%, cuatro veces al día durante 3 meses.39
No obstante, una revisión Cochrane41 reportó que, el uso de AINEs, asociados o no a otros tratamientos en el EMC tras cirugía de cataratas, no consigue una mejoría clínicamente significativa en la agudeza visual.
2.- Inhibidores de la Anhidrasa Carbónica (IAC)
Únicamente dos estudios42,43 analizan el efecto adicional de acetazolamida oral en comparación con los AINE tópicos o corticoesteroides en monoterapia. Ambos trabajos presentan mejores resultados funcionales y morfológicos de los AINE combinados con IAC. Sin embargo, no se evalúa el papel potencial de los IAC tópicos.
3.- Corticoesteroides
3.1.- Tópicos
Parece beneficioso la combinación de AINE con corticoesteroides tópicos.44 Sin embargo, no existen estudios con resultado estadísticamente significativo que respalden una mejoría adicional al tratamiento de AINE en monoterapia.45
3.2.- Perioculares
Los estudios retrospectivos analizados coinciden en presentar una mejoría morfológica y visual tras la inyección subtenoniana de triamcinolona acetónido.46,47,48
3.3.- Intravitreos
El implante de dexametasona (Ozurdex®) puede considerarse una opción de tratamiento para pacientes con síndrome de Irvine-Gass, incluso en casos con edema crónico (>4 meses) y en casos pretratados o refractarios.49
Sharma y cols.50, muestran un mejor resultado funcional en aquellos que inician un tratamiento intravítreo de corticoesteroides temprano.
4.- Anti-VEGF
Los anti-VEGF han demostrado una mejoría visual y morfológica con cualquier agente: Bevacizumab, Ranibizumab, Aflibercept.51,52 Akay y cols51 realizaron un estudio comparativo de los 3 agentes sin observar diferencias significativas en número de inyecciones ni en el resultado tras tratamiento. En el estudio PREMED6 la inyección intravítrea de Bevacizumab fue utilizada para los casos refractarios.
5.- Láser Micropulsado Subumbral
Un estudio de 2020,53, publicó los primeros resultados de aplicar laser amarillo micropulsado subumbral en 10 ojos de pacientes con EMC refractario a otros tratamientos. El análisis retrospectivo mostró una mejoría en la agudeza visual y en el grosor macular central mantenido hasta los 6 meses de seguimiento.
6.- Otros
Se han probado en algunos estudios la administración de Interferón – alfa (IFN-alfa). En un estudio54 se aplicaron 3 millones de unidades INF-alfa diarias, vía subcutánea durante 4 semanas, con reducción gradual secundaria, y se obtuvo una mejoría visual en todos los casos.
CONCLUSIONES
Por un lado, debemos destacar que la incidencia del EMC tras cirugía de cataratas (Irvine-Gass) varía en función del concepto que usemos para definirlo. Esta variabilidad en el concepto según los diferentes estudios analizados hace que las conclusiones no sean extrapolables.
Aunque los AINE y el pretratamiento en particular pueden acelerar la recuperación visual, ningún ensayo aleatorio, incluido el estudio PREMED, ha encontrado que los AINE mejoren los resultados de la agudeza visual a largo plazo.
Además, las limitaciones metodológicas generalizadas en los informes publicados con dosis desequilibradas y diferentes vidas medias de acción, impiden cualquier determinación de si un AINE utilizado en combinación con un esteroide proporciona un efecto sinérgico. En cuanto a los diferentes fármacos de AINE y corticoesteroides, se necesita más estudios que aclaren la superioridad de unos respecto a otros.
Por otro lado, la superioridad de los esteroides tópicos en el tratamiento para la prevención del EMC no se ha podido confirmar en los diferentes estudios. También se encuentran limitaciones metodológicas por uso de diferentes fármacos esteroides como tratamiento preventivo.
En cuanto al tratamiento una vez establecido el Irvine-Gass, tanto los AINEs como los corticoesteroides parecen una opción aceptada por la mayoría de los estudios dejando otras opciones de tratamiento más agresivas, para casos refractarios.
Actualmente, se busca “ahorrar” en el número de gotas que el paciente debe instilarse para evitar errores en el cumplimiento. Sin embargo, aunque los sistemas de administración «sin gotas» recientemente aprobados pueden mejorar el cumplimiento, aún es necesario realizar más estudios a largo plazo sobre la perdida de agudeza visual debido al EMC y, además, un análisis económico de los mismos.
BIBLIOGRAFÍA
Autores

Dra. Belén Figuerola García. FEBO
– Hospital Regional Universitario de Málaga, España.

Dr. Facundo Urbinati
– Hospital Regional Universitario de Málaga, España.
2 Comentarios
fernando aguilera
febrero 24, 2023Lo mas complejo es que el paciente detecte la baja visual ya que este emc tiene diferentes etapas de presentacion, lo que hace su dx mas complejo Nosotros utilizamos bromfenaco preop 3 dias BID en pacientes diabeticos o casos donde anticipamos mayores maniobras transoperatorias
Belen Figuerola
febrero 25, 2023Si, en el manejo preventivo del EMC postoperatorio es una buena opción a seguir, pues a partir de 2 dias preop se ha descrito en los estudios una disminución en la aparición del Irvine Gass. Además, el Bromfenaco tiene una buena penetrancia ocular. Sin embargo, el Nepafenaco (Nevanac®) es el único medicamento aprobado por la Agencia Europea del Medicamento para su uso en la prevención del EMC tras cirugía de cataratas en diabéticos.